

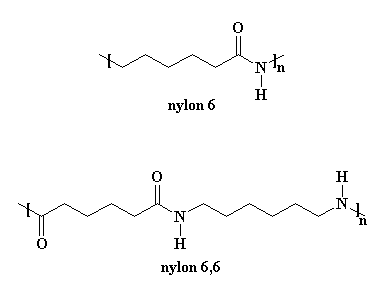
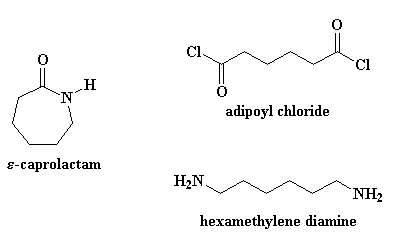
Maar die sintese van nylon 6 is baie verskillend van die van nylon 6,6. Nylon 6 word net van een monomeer gemaak, die monomeer kaprolaktaam. Nylon 6,6 word egter van twee monomere gemaak, adipoïelchloried en heksametileendiamien.
Maar kom ons kyk nou hoe ons kaprolaktaam in nylon 6 kan verander. Eerstens word die kaprolaktaam verhit tot 250 oC met so 5-10 % water bygevoeg. So, wat gebeur nou met kaprolaktaam as daar water in die omgewing is? Die karbonielkoolstof kyk rond, en sien 'n water molekuul waar daar 'n moontlikheid is om 'n waterstofatoom van te kry.
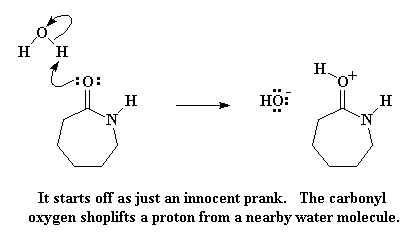
Die karbonielsuurstof doneer 'n paar elektrone aan die waterstof, en vorm 'n binding daarmee, en verwyder dit dus van die water. Dit lewer nou 'n geprotoneerde karboniel, en 'n vry hidroksied. Onthou van hierdie hidroksiedgroep, aangesien dit later weer 'n rol sal speel. Op hierdie stadium het die karbonielsuurstof egter 'n positiewe lading. Dit is nie baie gemaklik nie, so die suurstof kry 'n elektronpaar uit die karbonieldubbelbinding, wat nou 'n positiewe lading los op die karbonielkoolstof.
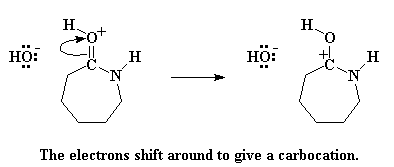
Maar 'n karbokatioon sal nie lank gelukkig bly nie. Daar word gevra vir 'n aanval deur 'n nukleofiel. En daar is natuurlik 'n nukleofiel in die omgewing, die hidroksied, wat nou die karbokatioon aanval.
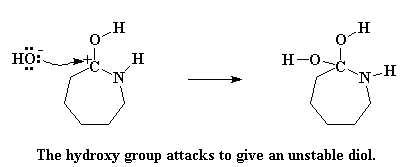
Die molekule wat gevorm is, word 'n geminale diol genoem. En dit is baie onstabiel. Wat volgende gebeur is 'n geskuiwery van elektrone om hierdie onstabiele situasie te probeer red. Die stikstofatoom doneer 'n paar elektrone aan 'n waterstofatoom op een van die hidroksielgroepe, en vorm dus 'n binding met die waterstof. Die elektrone wat die hierdie waterstof gedeel het met die suurstof, skuif nou om 'n dubbelbinding tussen die suurstof en die koolstofatoom te vorm. En ten laaste, die elektrone wat gedeel is deur die koolstof en die stikstof skuif geheel en al na die stikstof, wat die koolstof-stikstof binding breek.
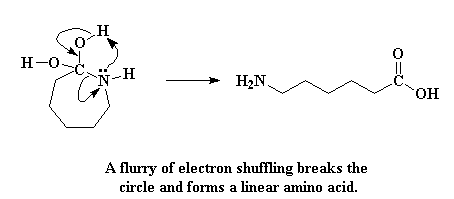
Wel, die ring is nou oop, en die kaprolaktaam bestaan nie meer nie. Al wat nou oor is, is 'n liniêre aminosuur!
Die reaksie is egter nou nog ver van oor af. Die liniêre aminosuur kan nou met 'n molekule kaprolaktaam reageer, baie soos die watermolekule het. En die karpolaktaammolekules is nie baie diskriminerend nie. Dit sal ook 'n waterstof by die liniêre aminosuur afneem. Die karbonielsuurstof doneer 'n paar elektron aan daardie waterstof, en verwyder dit dus van die aminosuur.
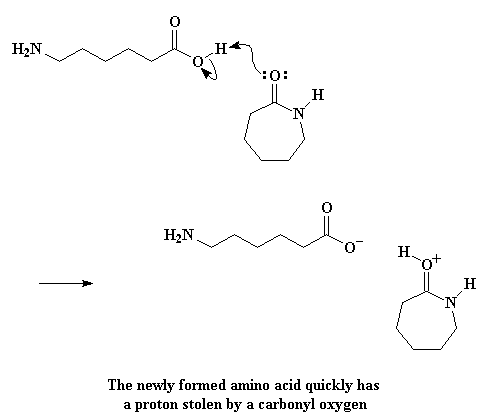
En, soos verwag, herrangskik die elektrone soos voorheen, om weer 'n karbokatioon te vorm:
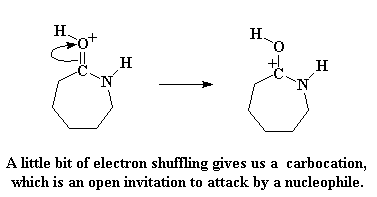
Die karbokatioon is net so oop vir aanval deur 'n nukleofiel soos voorheen, maar hierdie keer is daar ook 'n nuwe nukleofiel. Daar is 'n aminosuur wat nou net 'n suur proton verloor het, en val dan aan net soos ons vroër die hidroksiedgroep sien doen het.
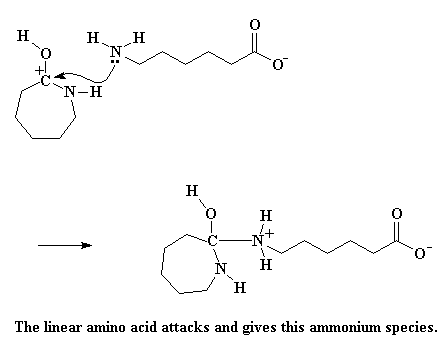
Dit lewer 'n ammonium spesie, maar 'n baie onstabiele spesie. Die elektrone skuif rond, en die ring stikstof steel 'n waterstof van die ammonium stikstof. Verder word die binding wat die stikstof en die koolstof in die ring aan mekaar verbind gebreek, en die ring gaan oop.
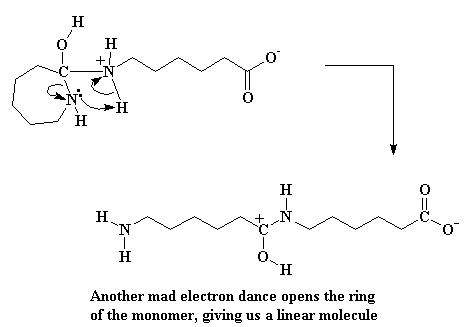
Maar ons is nog nie klaar nie. Die karboksilaatgroep aan die punt van die molekule buig om en neem 'n alkohol waterstof.
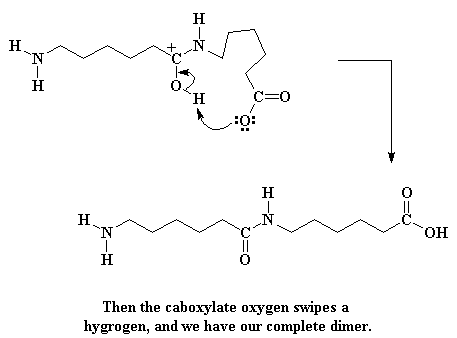
Dit maak dus 'n nuwe karbonielgroep in die middel van die molekule, en regenereer die karboksielsuur (Net 'n geheim: niemand weet regte in watter volgorde die laaste twee stappe plaasvind nie. Hulle mag dalk ook in omgekeerde orde as hier plaasvind. Ons weet egter net dat beide moet gebeur voordat die reaksie voltooi is.) As jy nou 'n film wil sien van die hele kettinggroei proses, kliek hier. (Onthou, hierdie is 'n kettinggroei polimerisasie.)
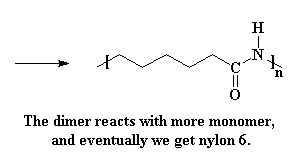
Nou dat ons weer 'n suur het, sal dit sekerlik weer reageer met 'n volgende kaprolaktaam molekule, en dan 'n volgende, tot ons 'n lang ketting nylon 6 het.
 Terug na die Nylon Bladsy
Terug na die Nylon Bladsy Terug na die Vlak Vier Kaart
Terug na die Vlak Vier Kaart Terug na die
Macrogalleria Indeks
Terug na die
Macrogalleria Indeks