

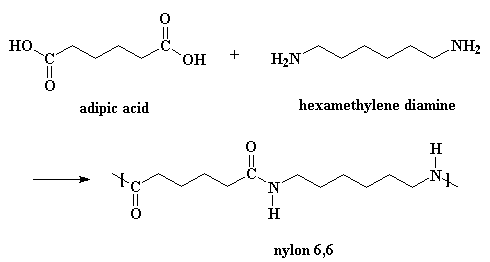
Daar is natuurlik 'n bietjie meer detail aan die reaksie as wat daar te sien is in die voorstelling.
Eerstens het hierdie reaksie 'n katalis nodig, en die katalis is 'n suur. Gelukkig is een van die reagense 'n suur, adipiensuur. 'n Reaksie vind plaas tussen twee adipiensuur molekules. Een doneer 'n proton aan die karbonielsuurstof van die ander.
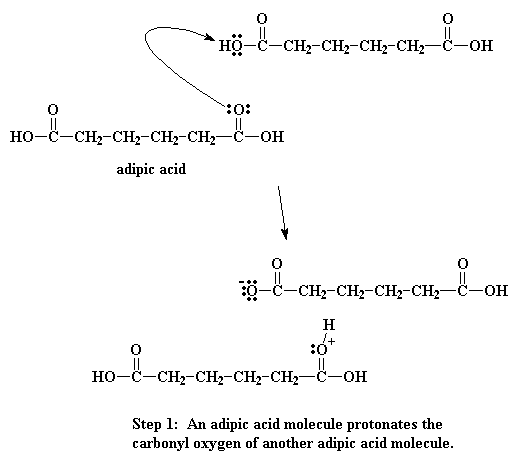
As hierdie suurstof geprotoneer word, word die karbonielkoolstof baie reaktief en kan maklik deur die stikstof van die diamied aangeval word. Dit is moontlik aangesien die geprotoneerde suurstof 'n positiewe lading dra. Suurstof is nie baie gelukkig met 'n positiewe lading nie, en trek dus die elektrone wat dit deel met die koolstof sterker aan. Dit laat dus die karbonielkoolstof met 'n laer elektrondigtheid, en gereed vir die amienstikstof om 'n elektronpaar te doneer.
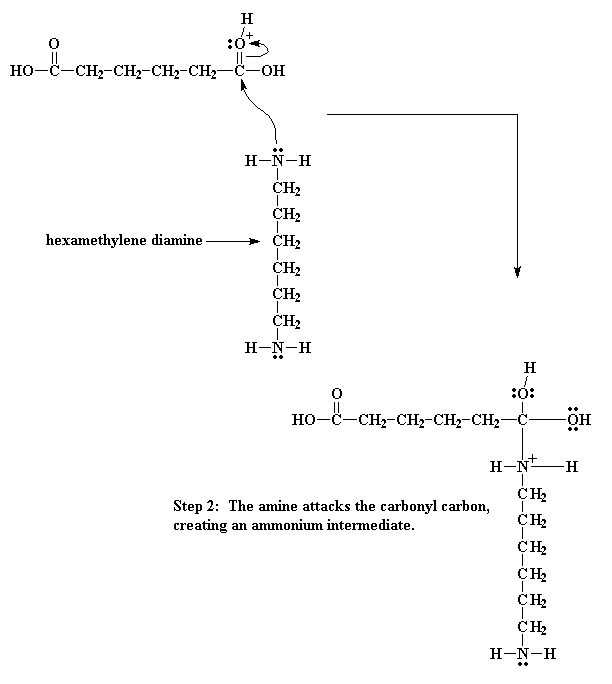
Daar vind nou 'n groot geskuif van elektrone plaas. Een van die elektronpare van die karbonieldubbelbinding skuif na die suurstof, en los so die probleem met die positiewe lading op die suurstof op. Maar die stikstof sit nou weer met 'n positiewe lading.
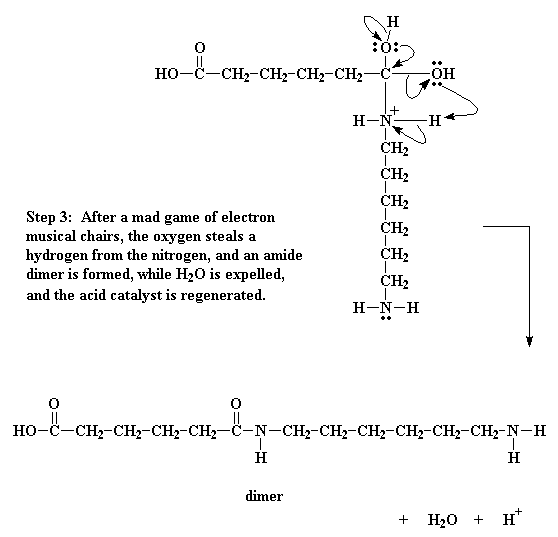
En nou gaan die elektronskuiwery voort. Die elektrone van die waterstof-suurstofbinding skuif terug na die suurstof, en maak dus weer die proton beskikbaar en regenereer die suurkatalis. Die karbonielsuurstof deel nou die weer die nuwe elektronpaar met die koolstofatoom, en regenereer weer so die karboniel dubbelbinding.
Dit is natuurlik nog nie genoeg nie. Die suurstof van die hidroksielgroep word ook nou betrek by die skuif. Die elektronpaar wat die binding tussen hierdie suurstof en koolstof maak, word nou geskuif tot op die suurstof, en breek dan so die binding. Dit doneer dan 'n paar elektrone aan 'n waterstof wat aan die stikstof verbind is.
Wel, aangesien die waterstof nou 'n paar elektrone met die suurstof deel, word die binding tussen die stikstof en die waterstof gebreek, en los die waterstof al die elektrone op die stikstof. So word die stikstof dan ontslae van die positiewe lading,
H2O word afgesplit, en 'n amiedbevattende dimeer word gegenereer.
En hoe lyk hierdie dimeer dan? Wel, daar sal 'n suurgroep aan die een punt wees, en 'n amiengroep aan die ander punt. Dit beteken dan dat die dimeer of met 'n disuur kan reageer, of met 'n diamien. En beide hierdie reaksies gaan 'n trimeer lewer.
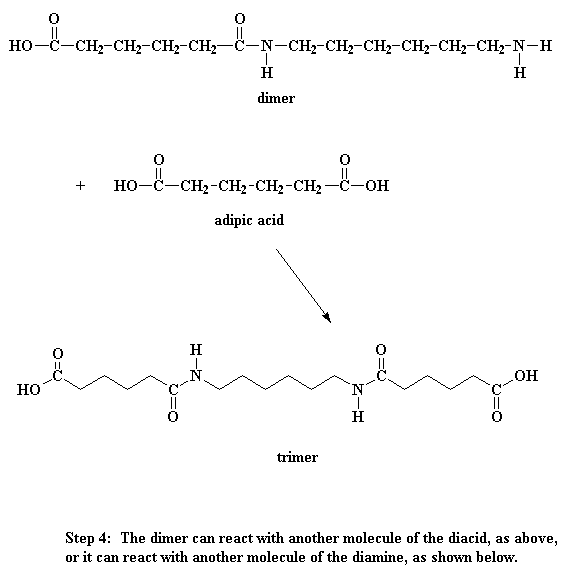
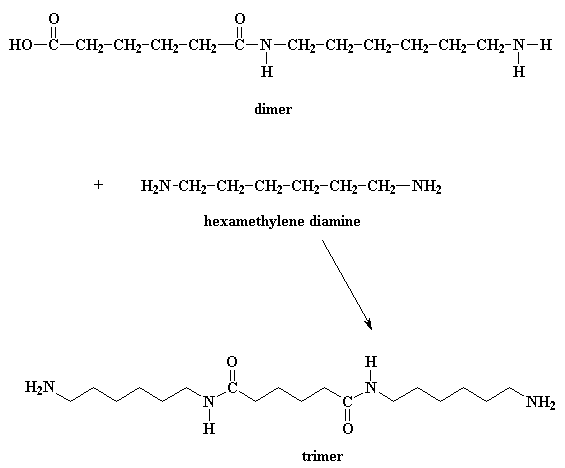
Iets wat jy ook in gedagte moet hou is dat die dimeer ook met ander dimere kan reageer om tetramere te vorm. Of dit kan met 'n trimeer reageer om 'n pentameer te vorm, of dit kan met groter oligomere reageer. En uiteindelik sal die oligomeremet mekaar reageer om selfs nog groter oligomere te vorm. Die finale produk van al hierdie reaksies sal natuurlik polimere wees.
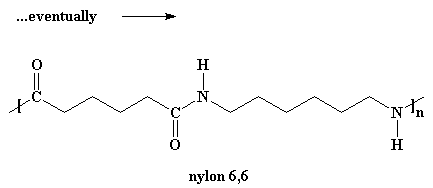
Om hierdie molekules groot genoeg te laat raak (sodat hulle polimere vorm) moet die reaksie onder vakuum uitgevoer word. As dit gedoen word, sal die byproduk water verdamp en weggesuig word. Ons moet van die water ontslae raak, a.g.v. iets met die naam van Le Chatlier se Beginsel.
Wat van nog 'n bietjie inligting?
Nylons kan ook van 'n diamien en 'n disuurchloried gemaak word:
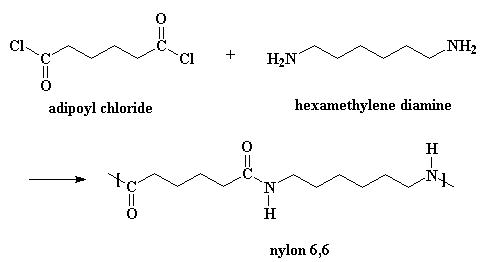
Hierdie reaksie verloop volgens dieselfde meganisme, maar jy benodig 'n klein bietjie suur om as katalis op te tree. (Onthou, as mens nylon maak op die ander manier, tree die adipiensuur op as katalis.) Verder produseer hierdie reaksie HCl as byproduk, i.p.v. water. As jy 'n film wil sien van hierdie metode, kliek hier.
 Terug na die Nylon Bladsy
Terug na die Nylon Bladsy Terug na die Vlak Vier Kaart
Terug na die Vlak Vier Kaart Terug na die
Macrogalleria Indeks
Terug na die
Macrogalleria Indeks