

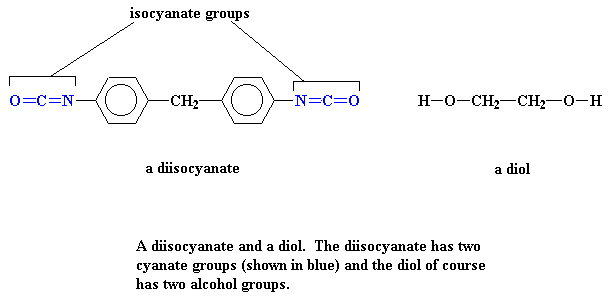
Of kyk na hulle in 3d deur hier te kliek.
Ons kan hierdie twee laat polimeriseer met die hulp van die molekuul met die naam van diasobisiklo[2.2.2]oktaan, of DABCO. As ons die twee monomere en 'n bietjie DABCO meng, begin dinge gebeur.
DABCO is a baie goeie nukleofiel, d.w.s., dit het 'n paar ongedeelde elektrone wat baie graag met 'n kern (nukleus) wil assosieer (onthou elektrone het negatiewe en kerne positiewe ladings, en die trek mekaar altyd aan). So DABCO sal reageer met die alkohol waterstowwe van die diol. Die waterstowwe is oop vir aanval, aangesien hulle aan 'n elektronegatiewe suurstof verbind is (wat die elektrone sterk na homself sal aantrek). Die waterstowwe dra dus 'n parsiële positiewe lading, en maak dit dus die perfekte plek vir 'n nukleofiel om aan te val.
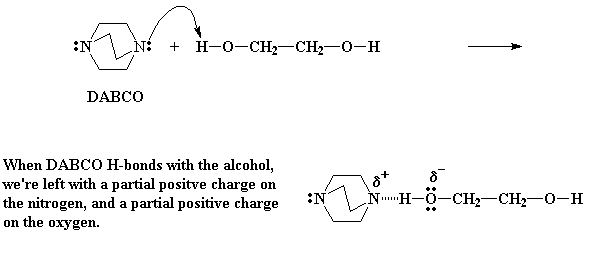
So, DABCO kom nader, en vorm 'n waterstofbinding tussen die waterstof en die stikstof van die DABCO. Die waterstofbinding los nou 'n parsiële lading op die stikstof, maar nog belangriker, 'n parsiële negatiewe lading op die suurstof. Dit los dus nou die suurstof met 'n oormaat elektrone, wat dit baie graag sal wil laat reageer.
En dit sal nou wil reageer met 'n spesie wat arm is aan elektrone. As jy nou na die isosianaat kyk, sal jy sien dat daar 'n koolstof tussen twee elektronegatiewe elemente, suurstof en stikstof, lê. Dit beteken dus dat die koolstof baie arm is aan elektrone, en gereed is vir aanval deur 'n spesie ryk aan elektrone. Wel, die suurstof doneer dus nou 'n paar elektrone, en 'n binding word dus gevorm.
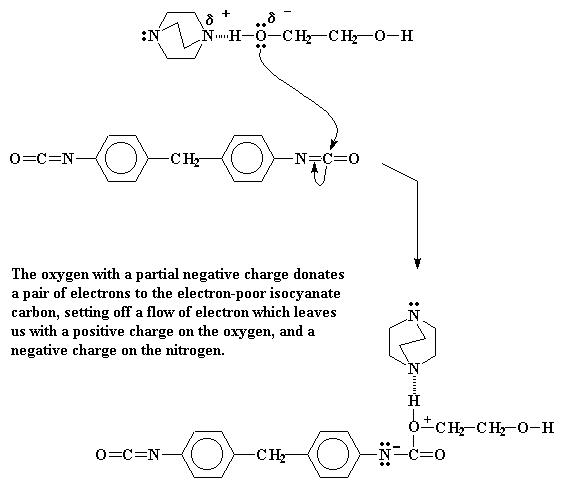
Dit stoot natuurlik nou 'n paar elektrone uit die koolstof-stikstof dubbelbinding uit. Hierdie elektronpaar sit nou op die stikstof, wat dit 'n negatiewe lading gee. Die suurstof aan die anderkant, wat 'n elektronpaar gedoneer het, dra nou 'n positiewe lading.
Die stikstof sal nou probeer om so vinnig as moontlik ontslae te raak van die negatiewe lading. En die maklikste manier is om 'n paar elektrone aan die alkohol waterstof te doneer. Daar vorm dus 'n binding tussen die waterstof en die stikstof.
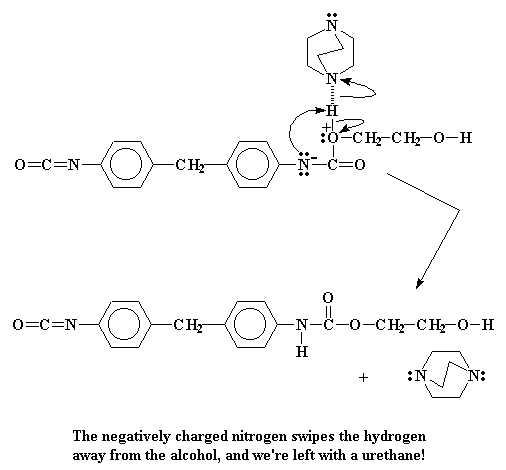
Die elektrone wat die waterstof met die suurstof gedeel het, behoort nou net aan die suurstof. Dit elimineer die positiewe lading wat die suurstof gedra het. As al hierdie reaksies dus nou verby is, dan sit ons met 'n nuwe uretaan dimeer.
Hierdie uretaan dimeer het 'n alkoholgroep aan die een punt, en 'n isosianaatgroep aan die ander punt. Dit kan dus nou met of 'n diol of 'n diisosianaat reageer om 'n trimeer te vorm. Of dit kan met 'n ander dimeer, of trimeer, of selfs hoër oligomeer reageer. Op hierdie wyse kan monomere en oligomere kombineer totdat ons 'n hoë molekulêre gewig poliuretaan het.
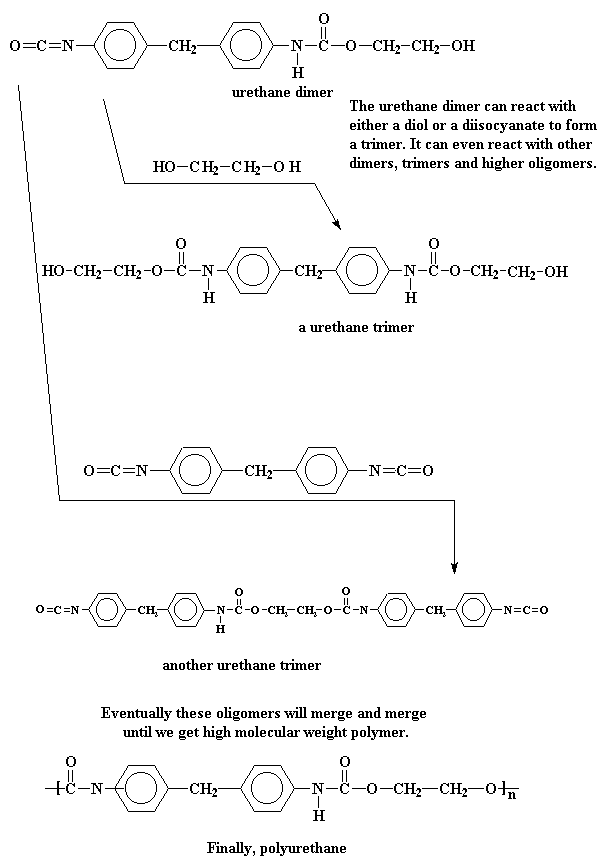
Soos jy dalk nog kan onthou, word so 'n tipe polimerisasie 'n stapsgewyse groei polimerisasie genoem. Verder, omdat geen klein molekules as byprodukte gevorm word nie, is dit ook 'n addisie polimerisasie.
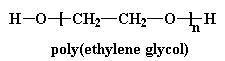
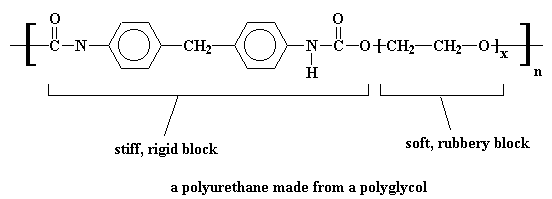
Dit gee dan vir ons 'n polimeer binne 'n polimeer, en kry ons 'n poliuretaan wat byna so sal lyk:
As jy wil, kan jy hier leer hoe om poliuretaan skuim te maak.
 Terug na die Poliuretaan Bladsy
Terug na die Poliuretaan Bladsy Terug na die Vlak Vier Kaart
Terug na die Vlak Vier Kaart Terug na die
Macrogalleria Indeks
Terug na die
Macrogalleria Indeks