sekondêre interaksie, hidrodinamiese volume
Polimere doen iets baie interessant wanneer jy hulle in 'n oplosmiddel sou oplos: hulle verhoog die viskositeit van die oplossing. En dit het jy al baie gesien. Polimere word as verdikkers in shampoe en selfs partykeer roomys gebruik. Hierdie verdikkingseffek kan gebruik word om die polimeer se molekulêre gewig te bepaal. As jy teen hierdie tyd nog nie die gedeelte oor molekulêre gewig gelees het nie, doen dit gerus nou.Maar voor ons begin praat oor molekulêre gewig, kom ons vra eers die volgende vraag:
Hoekom verhoog polimere 'n oplossing se viskositeit?
Eerstens, polimere beweeg baie stadig, of dan heelwat stadiger as klein molekules. Dit maak sekerlik sin, want hoe vinniger die molekules in 'n vloeistof beweeg, hoe vinniger en makliker kan die vloeistof beweeg. So, as ons 'n polimeer in 'n oplossing oplos, veroorsaak hulle stadige beweging dat die hele oplossing meer viskoos raak.
Die antwoord is ja. Dit is nie genoeg vir die polimeermolekules om stadig te beweeg nie, maar laat selfs ook die oplosmiddel molekules stadiger beweeg. Maar hoekom doen die polimere dit, en hoe kry die polimeermolekules dit dan reg? Goed. Polimere is stadig, maar hoekom raak die hele oplossing meer viskoos. Maak dit ook die oplosmiddel molekules stadig? Hoe werk dit?
Om dit dalk so 'n bietjie duideliker te maak, dink daaraan asof jy op 'n lang naweek gaan. Jy spring in jou kar, maak die sondak oop, en jaag teen 'n groot spoed weg by die huis. Sodra jy op die oop pad kom, kom jy agter die verkeer beweeg al hoe stadiger, en dat die wind nie meer heeltemal so lekker by die sondak inwaai nie. Later moet jy na 'n laer rat verwissel, en uiteindelik ry jy teen 60 km/h op die hoofweg. As jy vorentoe kyk, verby al die ander gefrustreerde, stadig bewegende motors, sien jy 'n groot stasiewa wat 'n karavaan sleep, in die middel van die vinnige baan. En die wa ry teen 60 km/h. Jy weet sommer, jy gaan vanaand eers baie laat by jou bestemming aankom...
Wel, so voel die klein oplosmiddel molekule as die polimeermolekule ALLE verkeer in die oplosmiddel byna tot stilstand dwing. Alles beweeg stadiger, en die hele oplossing is meer viskoos.
Behalwe vir die fisiese blokkering van die klein molekules se beweging deur die polimeer molekules, word die klein molekules ook stadiger gemaak deur intermolekulêre kragte. As daar aantrekkende sekondêre kragte tussen die polimeer en die oplosmiddel molekules is, kan die oplosmiddel verbind word aan die polimeer. As dit gebeur, beweeg die klein molekules maar meestal saam met die polimeer, teen sy lae spoed. Dit is byna asof die klein molekules nou satteliete word rondom die polimeer, en daar vasgevang word om saam met die polimeer te moet beweeg.
Hierdie verandering in viskositeit van die oplossing help jou om die molekulêre gewig te voorspel a.g.v. hierdie eenvoudige rede: Hoe hoër die molekulêre gewig, hoe meer viskoos sal die polimeer oplossing wees. Dit is heel verstaanbaar. As 'n polimeer 'n hoër molekulêre gewig het, sal dit 'n groter hidrodinamiese volume hê; dit is die volume wat die opgevoude polimeer in oplossing sal beslaan. En hoe groter die polimeer molekule is, hoe meer oplosmiddelmolekule se beweging sal vertraag word. En hoe groter die polimeer is, hoe groter sal sy sekondêre kragte wees. Onthou jy nog die konsep van summasie van molekulêre kragte? Hoe hoër die molekulêre gewig, hoe sterker word die oplosmiddel molekules aan die polimeer verbind. Dit help natuurlik om die oplosmiddel molekule stadiger te laat beweeg. So, polimere maak oplossings meer viskoos. Maar wat het dit nou te doen met die meet van molekulêre gewig?
Vir omtrent elke polimeer is daar 'n defnetiewe verhouding tussen molekulêre gewig en viskositeit. So, sodra jy die viskositeit bepaal het, dan kan jy die molekulêre gewig bepaal. En dit is waaroor daar volgende gepraat gaan word: die meet van die viskositeit van 'n polimeer oplossing.
Meet van die Polimeer Oplossing Viskositeit
Hoe meet ons die viskositeit van 'n polimeer oplossing? Dit is eintlik baie eenvoudig. Ons neem net 'n buis soos die een hier onder, en meet hoe lank dit neem vir 'n spesifieke volume om deur die buis te vloei.Om te verseker dat ons dieselfde volume elke maal meet, neem ons die tyd wat dit neem vir die vlak van die oplossing om te val van die eerste lyn (a in die figuur) tot by die tweede lyn (b). Die groot verdikking in die buis is net om die volume tussen die twee lyne te vergroot. Sonder so 'n vergroting sou die vloeistofvlak te vinnig geval het om akkuraat elke keer gemeet te kon word. 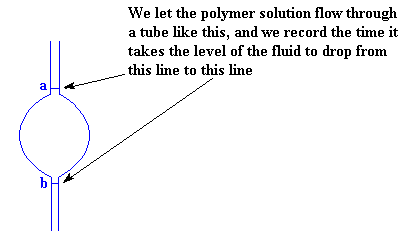
So, nou weet ons hoe om die tyd te meet wat dit sou neem vir die vloeistofvlak om te val, die sogenaamde uitvloeityd ("efflux time"). Dit is egter so dat ons nie net een uitvloeityd gaan meet nie. Ons gaan die uitvloeitye van oplossings met verskillende polimeer konsentrasies in meet. Ons sal ook die uitvloeityd van die suiwer oplosmiddel, met geen polimeer in opgelos nie, meet as verwysing.
So wat doen ons nou met hierdie syfers? Die eerste ding wat ons doen is om hulle name te gee. Die uitvloeityd van die suiwer oplosmiddel word t0 genoem. Dan vir so 'n bietjie wiskunde. Die eerste ding wat ons moet bereken is die viskositeite van die polimeeroplossings relatief tot die viskositeit van die suiwer oplosmiddel. Ons doen dit deur die uitvloeityd van 'n polimeeroplossing van 'n spesifieke konsentrasie (ons noem dit t) te deel deur t0, die uitvloeityd van die suiwer oplosmiddel. Dit gee vir ons die relatiewe viskositeit. Ons gebruik die griekse letter eta om relatiewe viskositeit aan te dui.
Ons sal nou binnekort die relatiewe viskositeit gebruik, maar eerste sal ons nog berekeninge doen met die uitvloeitye. Hierdie keer gaan ons nie kyk na die uitvloeitye relatief tot die van die oplosmiddel nie. Ons sal eerder kyk na die verskil tussen die uitvloeitye van die suiwer en polimeeroplossing, relatief tot die uitvloeityd van die suiwer oplosmiddel. Ons trek dus die uitvloeityd van suiwer oplosmiddel, t0, van die uitvloeityd t van die polimeeroplossings. Die antwoord wat ons kry word deur t0 gedeel. Ons noem dit die spesifieke viskositeit. Alles nog onder beheer? Hier volg die vergelykings: 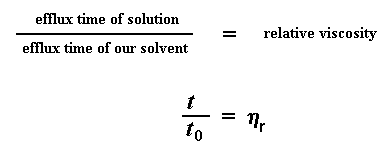
Ons neem nou die spesifieke viskositeit, en verdeel dit deur die konsentrasie van die oplossing, en ons kry dan die sogenaamde gereduseerde viskositeit: 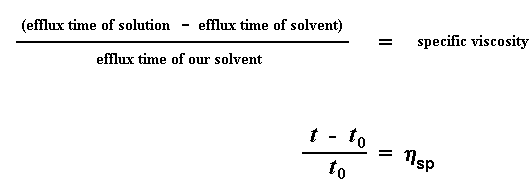
Jy mag dalk gesien het dat ons verskillende gereduseerde viskositeite by die verskillende konsentrasies sal kry (onthou ons neem metings by verskillende polimeer konsentrasies). As ons nou die gereduseerde viskositeit plot op die y-as, en die konsentrasies op die x-as, kry ons 'n grafiek wat dalk so sal lyk: 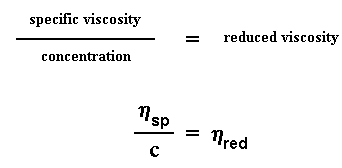
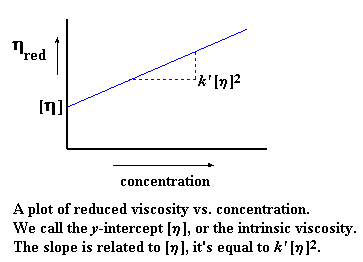
As ons hierdie grafiek trek, noem ons die helling van die grafiek k'. As ons die lyn sou ekstrapoleer terug na zero konsentrasie om die y-afsnit te verkry, kry ons die intrinksieke viskositeit. Dit gee natuurlik vir ons 'n vergelyking in die vorm van y = mx + b, waar
die helling is van die lyn, en b die y-afsnit:
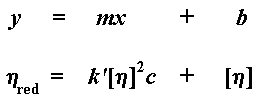
k'[n]2 is natuurlik m, die helling van die lyn, en [n] is b, die y-afsnit. Die intrinsieke viskositeit is 'n baie belangrike waarde, want dit is die enigste een waaruit ons die molekulêre gewig kan verkry.
Voor ons nou verder gaan en die molekulêre gewig bereken uit die intrinsieke viskositeit, moet ons eers 'n tweede manier ondersoek om intrinsieke viskositeit mee te bereken. Onthou jy nog relatiewe viskositeit? Ons gaan dit nou hier gebruik. As ons die natuurlike logaritme van die relatiewe viskositeit neem, en dit deel deur die konsentrasie van die oplossing wat ons gemeet het, kry ons die inherente viskositeit.
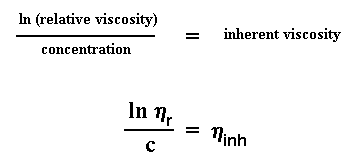
Nou, net soos vir gereduseerde viskositeit, is daar 'n verskillende viskosteit vir elke konsentrasie wat ons bepaal. Ons kan dus 'n grafiek trek van inherente viskositeit op die y-as, en die konsentrasie op die x-as. Ons kry dan 'n grafiek wat so lyk:
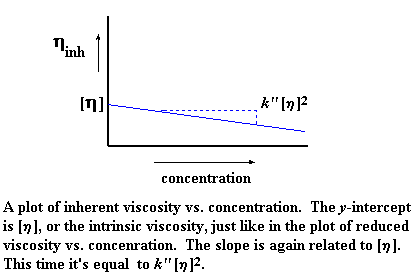
Hier is [n] weer ons afsnit, maar die helling is hierdie keer verskillend, naamlik k'' [n]2. Ja, die grafiek is weer eens 'n lyn wat deur die bekende vorm beskryf word. Hier word dit meer duidelik gestel:
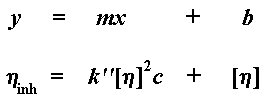
Ons gebruik gewoonlik beide metodes om die intrinsieke viskositeite te bepaal. As hulle ooreenstem, dan weet ons ons het alles reg gedoen. Ons plot gewoonlik die twee grafieke op dieselfde assestelsel, met die twee lyne wat met mekaar kruis:
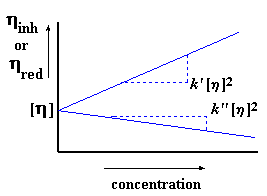
Nog 'n manier om te toets of alles in orde is, is as k' - k'' gelyk is aan 0.5
Ons het nou al baie berekeninge gedoen, maar ons het nog steeds nie 'n molekulêre gewig nie. Hoe nou gemaak?
Wel, ons het die intrinsieke viskositeit nodig om die molekulêre gewig te kan bereken. So, ons moet dit eers kan bereken, voor ons die volgende eenvoudige vergelyking kan gebruik om die molekulêre gewig te kan bereken:
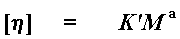
Hierdie word die Mark-Houwink vergelyking genoem. M word die viskositeit gemiddelde molekulêre gewig genoem, en K' en a is die Mark-Houwink konstantes. Daar is 'n spesifieke stel Mark-Houwink konstantes vir elke polimeer-oplosmiddel kombinasie. Jy moet dus hierdie konstantes ken vir jou spesifieke polimeer-oplosmiddel kombinasie, om 'n akkurate molekulêre gewig te kan bereken. Dit beteken dus jy sal nie so 'n goeie meting verkry as jy nou net 'n nuwe polimeer uitgevind het nie, en daar is geen Mark-Houwink konstantes beskikbaar nie. Maar dit kan jou nog steeds 'n kwalitatiewe idee gee of die molekulêre gewig hoog of laag is. Jy kan baie afleidings maak uit 'n intrinsieke viskositeit, en soms is dit die enigste manier om te sien of dit wat jy gemaak het regtig 'n polimeer is.
Net 'n laaste dingetjie: Jy moet verdunde oplossings gebruik om hierdie tipe bepalings te kan doen. As die oplossings te gekonsentreerd is, sal die polimeermolekules dalk te na aan mekaar kom, en groot interaksie toon. Dit sal veroorsaak dat die viskositeite sal toeneem op maniere wat nie deur die bostaande vergelykings beskryf word nie. Sulke metings sal dus nie akkuraat gemaak kan word nie. Dit is hoekom hierdie tegniek verdunde oplossing viskometrie genoem word.
As jy van nog maniere wil weet om molekulêre gewig te bepaal, lees gerus hier:

 Terug na die Vlak Vyf Kaart
Terug na die Vlak Vyf Kaart