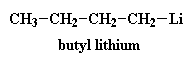
Parole chiave
anione
catione
polimerizzazione vivente
legame covalente
terminazione
La polimerizzazione anionica vinilica è un metodo per ottenere i polimeri da piccole molecole contenenti doppi legami carbonio-carbonio. E' un tipo di polimerizzazione vinilica. Nella polimerizzazione anionica il processo viene avviato da un iniziatore. In questo caso, l'iniziatore è un anione, ossia uno ione con una carica elettrica negativa.
Vengono utilizzati diversi tipi di iniziatori nella polimerizzazione anionica vinilica, ma quello più utilizzato è una piccola molecola senza pretese chiamata butillitio.
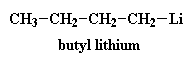
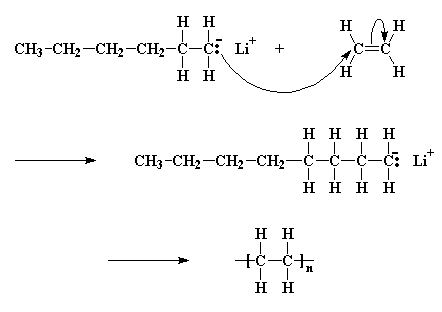
Ora, una piccola parte delle molecole di butillitio si scindono; non molte, solo qualcuna. Si scindono per formare un catione litio (Li+) ed un anione butilico (R-CH2-). Chiamiamo un anione come questo, dove la carica negativa si trova su un atomo di carbonio, un "carbanione":
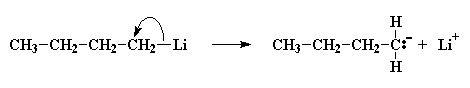
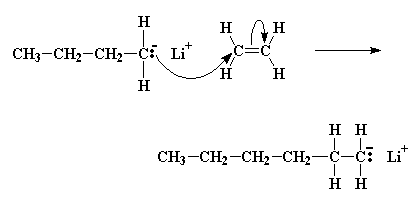
Una coppia di elettroni verrà donata dall'anione butile a uno degli atomi di carbonio del doppio legame del monomero. Questo atomo di carbonio ha già otto elettroni nel suo strato più esterno che condivide con gli atomi ai quali è legato, quindi una coppia di questi elettroni, in particolare un coppia del doppio legame carbonio-carbonio, lascerà l'atomo di carbonio e si stabilirà sull'altro atomo di carbonio del doppio legame. Questo da origine ad un nuovo carbanione, la cui carica negativa rimane su quel carbonio. Il processo con il quale il butillitio si scinde e l'anione butile reagisce con una molecola di monomero viene chiamato reazione di inizio.
Per vedere un filmato delle reazioni di inizio clicca qui
Il carbanione ora reagisce con un'altra molecola di monomero nello stesso modo in cui l'iniziatore ha reagito con la prima molecola del monomero; viene generato un altro carbanione. Questo continua a succedere ed ogni volta che si aggiunge un altro monomero alla catena in crescita, viene generato un nuovo anione che permette l'aggiunta di un ulteriore monomero. In questo modo cresce la catena del polimero. Questa continua aggiunta di monomero dopo monomero viene detta propagazione.
Per vedere un filmato delle reazioni di propagazione clicca qui
Ora potreste avere la sensazione che questo non possa andare avanti per sempre, che qualche cosa debba fermare questo processo. Strana cosa, comunque non si ferma! In molti casi, l'unica modo per frenare i monomeri nella loro crescita sulla catena è non avere più molecole di monomero nel beaker! Anche in questo caso, se qualcuno passasse di lì più tardi e gettasse dell'altro monomero nel beaker, si aggiungerebbero alla catena e la catena continuerebbe a crescere! E' noto che alcune catene di polistirene sono rimaste attive così per anni. Per fermarle è necessario aggiungere al polimero dell'acqua che reagisce con i carbanioni. I sistemi come questo vengono detti polimerizzazioni anioniche viventi. Questo ci permette di realizzare alcuni trucchi interessanti�
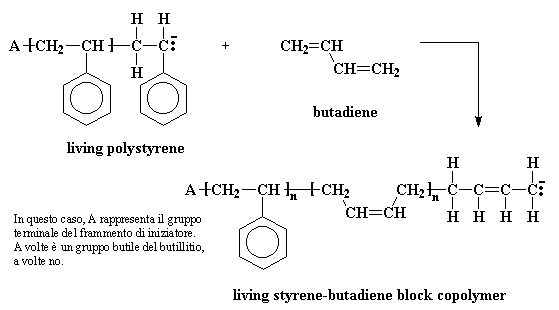
picture caption: In questo caso, A rappresenta il gruppo terminale del frammento di iniziatore. A volte è un gruppo butile del butillitio, a volte no.
Qualche tempo fa qualcuno stava meditando sul bicchiere pieno di polimero che restava attivo per anni; e su come aggiungendo un monomero, lo stesso si aggiungesse alle catene viventi di polimeri e gli venne un'idea. Invece di aggiungere lo stesso monomero alla soluzione in cui era il polimero attivo perché non aggiungere un polimero diverso? Il risultato fu un polimero le cui catene erano costituite da una lunga fila di un tipo di polimero e da una seconda fila dell'altro polimero. Questi polimeri vengono detti copolimeri a blocchi. Ad esempio un soluzione di catene di polistirene attivo reagirà con il butadiene per dare origine a un copolimero a blocco stirene-butadiene.
Alcuni altri trucchetti ci daranno un copolimero a tre blocchi stirene-butadiene-stirene. Volete sapere come abbiamo fatto? Per scoprirlo cliccate qui.

![]() Ritorna
all'Indice della Macrogalleria
Ritorna
all'Indice della Macrogalleria