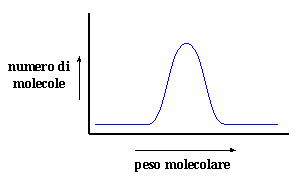

Se avete letto la pagina sul peso molecolare (se non lo avete ancora fatto leggetela ora cliccando qui) vi ricorderete che le molecole di un campione di polimero non hanno tutte lo stesso peso molecolare. Si ha una distribuzione dei pesi. C'è un picco del peso molecolare medio, che viene denominato peso molecolare medio numerico o Mn. Naturalmente ci saranno sempre catene polimeriche con pesi maggiori e minori del peso molecolare medio. Se tracciamo un grafico dove abbiamo il peso molecolare sull'asse-x ed il numero delle catene che hanno un peso molecolare specifico sull'asse-y, otteniamo questo grafico:

(Lo so che normalmente i grafici come questo mostrano l'aumento del peso molecolare da destra a sinistra. Ho rappresentato l'aumento del peso molecolare da sinistra a destra per un motivo particolare. Ve lo spiegherò tra poco) Un metodo per ottenere questo tipo di grafico è quello di utilizzare la cromatografia di esclusione sterica o SEC. Ma la SEC non misura effettivamente il peso molecolare, misura il volume idrodinamico, ossia la dimensione della catena polimerica raggomitolata in una soluzione. Questo ci da un misura relativa del peso molecolare , in quanto ovviamente più è elevato il peso molecolare più grande sarà il volume idrodinamico. A volte però è necessario sapere l'esatta distribuzione del peso molecolare. Per questo alcuni brillanti scienziati hanno inventato un processo denominato spettroscopia MALDI, ovvero spettroscopia di massa mediante desorbimento laser e ionizzazione assistita dalla matrice. Viene anche denominata solamente MALDI.
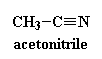
Cos'è quindi questa cosa fantastica chiamata MALDI? Per farvi capire spiegheremo tutto il processo MALDI per vedere come funziona. Prima di tutto prendiamo il nostro polimero e lo dissolviamo in un solvente. Che tipo di solvente? Dipende, i primi esperimenti MALDI venivano realizzati con le proteine. Le proteine tendono ad essere solubili in acqua quindi l'acqua era il solvente primario. Si usava di norma una miscela 70:30 di acqua e acetonitrile (cliccate qui per vederla in 3-D). Il solvente utilizzato dipende dal tipo di solvente che può dissolvere il polimero che state studiando.
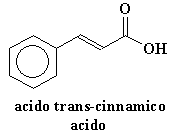
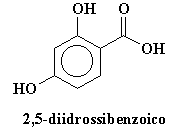
Abbiamo anche aggiunto uno speciale ingrediente, un composto come l'acido trans-cinnamico o 2,5 acido diidrossibenzoico. Varia da polimero a polimero ma la cosa importante è che il nostro ingrediente speciale deve assorbire la luce ultravioletta. Normalmente usiamo una quantità di assorbitore UV maggiore di 104 rispetto al nostro polimero. Cliccate sulle formule per vederle in 3-D. Una volta miscelato il tutto il campione viene posto in una camera a tenuta d'aria, sull'estremità della sonda campione (guardate la figura qui sotto). Con una pompa a vuoto risucchiamo tutta l'aria presente nella camera, o almeno quasi tutta. Mentre facciamo questo il solvente evapora e rimane uno strato del nostro composto UV assorbitore, contenente una piccola quantità di polimero. Noi diciamo che il polimero ora è disperso in una matrice del composto UV assorbirtore. Questo è il processo denominato spettroscopia di massa "MALDI".
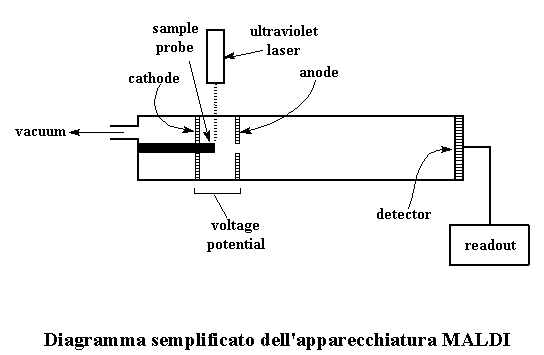
Qualcuno ha detto laser? Si, giusto, a questo punto dobbiamo colpire con il laser il nostro campione. Normalmente viene utilizzato un laser a ultravioletti a 330-360 nm. Ricordate che il nostro campione è carico di materiale che assorbe gli UV. Ama la luce UV e non ne ha mai abbastanza. Assorbe tutta l'energia attraverso le molecole del polimero. Il materiale matrice inoltre reagisce con i polimeri in modo da trasformare i polimeri in ioni con carica elettrica. Nessuno sa come avviene effettivamente, il fatto che i polimeri ora siano ionici è molto importante e lo scoprirete tra poco. Prima torniamo a tutta quella energia che i polimeri stanno assorbendo dal materiale matrice. Quando assorbono tutta quella energia alcune molecole polimeriche fanno una cosa che i polimeri non fanno quasi mai. Evaporano. Di solito le molecole polimeriche sono troppo grandi e pesanti per evaporare, ma a queste temperature così elevate con pressioni così basse, possono farlo. Ecco l'origine del termine desorbimento. Adesso che i nostri polimeri fluttuano nel loro stato gassoso, è ora che io vi dica una cosa importante su questa camera. Alla fine della camera dove avviene l'evaporazione delle molecole del nostro polimero abbiamo messo due elettrodi, un catodo positivo e un anodo negativo. A seconda del tipo di polimero e al tipo di matrice utilizzata i polimeri possono diventare anioni o cationi. Per questa spiegazione consideriamo i polimeri che formano cationi positivi. Quando vaporizziamo il nostro polimero, lo vaporizziamo proprio tra i due elettrodi. Quando il nostro polimero forma i cationi, posizioniamo il catodo positivo proprio dietro il campione e l'anodo negativo davanti al campione. (Guardate il diagramma) Naturalmente i polimeri con carica positiva si dirigeranno verso l'anodo, attratti dalla sua carica negativa. Se abbiamo agito correttamente possiamo utilizzare questa accelerazione per spingere le molecole di polimero verso il rivelatore nel misuratore posto nella parte finale della camera. La maggior parte delle volte, si ha una sola carica positiva su ogni molecola di polimero. Questo significa che la stessa forza elettrica viene applicata ad ogni molecola di polimero quando viene accelerata nel campo elettrico tra i due elettrodi. Ricordatevi che le molecole di polimero hanno masse differenti. Cosa diceva Isaac Newton su massa, forza ed accelerazione? Penso fosse una cosa tipo questa
Ossia la forza è uguale alla massa per accelerazione. Possiamo leggere l'equazione anche in questo modo
Se non lo avete ancora capito, mantenendo costante la forza, maggiore è la massa, minore è l'accelerazione. Per noi questo significa che più sono pesanti le molecole polimeriche più elevato sarà il tempo necessario per raggiungere il rivelatore posto alla fine della camera.
I polimeri colpiranno il rivelatore, i più piccoli per primi, poi quelli più grandi. Colpiscono lo strumento in ordine di massa. Tutte le molecole polimeriche con lo stesso peso molecolare raggiungeranno il rivelatore nello stesso momento. La dimensione del picco è proporzionale al numero di molecole che colpiscono il misuratore nello stesso momento. Alla fine dell'esperimento otteniamo una serie di picchi che vengono rappresentati così:
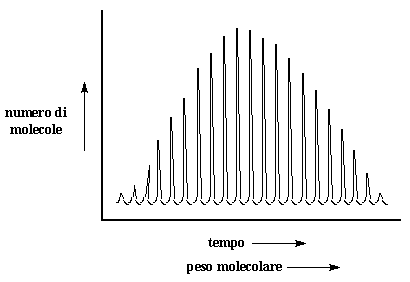
Poiché il tempo necessario ad una molecola per colpire il rivelatore è proporzionale alla sua massa ciò che otteniamo è in effetti un grafico del peso molecolare sull'asse-x ed il numero di molecole con un determinato peso molecolare sull'asse-y. In questo modo otteniamo la distribuzione del peso molecolare. Unite le estremità dei picchi nel modo in cui si collegano i puntini ed otterrete una curva come quella raffigurata nella pagina in alto. Non a voi, ma a me lo spettro MALDI ricorda sempre la pinna dorsale di un dimetredonte, un rettile estinto che ha vissuto milioni di anni fa.

Un altro piccolo dettaglio che potete notare è che il peso molecolare su questo grafico aumenta da sinistra a destra. Su un grafico SEC, che vedrete più spesso, il peso molecolare aumenta da destra a sinistra. (Riuscite a capire il perché?). Questo a volte può confondere le idee per cui ricordatevelo sempre.
Ci sono altre differenze importanti tra SEC e MALDI. SEC vi da una distribuzione approssimativa del peso molecolare. SEC misura il volume idrodinamico e non il peso molecolare . Possiamo avere un'approssimazione del peso molecolare confrontando il volume idrodinamico del polimero che abbiamo analizzato con quello di un polimero standard, di solito il polistirene, del quale è nota l'esatta relazione tra volume idrodinamico e peso molecolare. Questo ci da solo un risultato approssimativo in quanto la relazione tra il peso molecolare ed il volume idrodinamico non è sempre uguale per tutti i polimeri. Ma MALDI misura la massa in modo più accurato, in quanto non fa alcun confronto con il polimero che state misurando con nient'altro. Fornisce una misurazione assoluta della massa. Fra non molto probabilmente MALDI sostituirà SEC nella maggior parte dei laboratori.
 Ritorna
al quinto piano
Ritorna
al quinto piano
 Ritorna
all'indice della Macrogalleria
Ritorna
all'indice della Macrogalleria