

Faccio una supposizione folle, visto che stai per leggere questa pagina; tu puoi, A) non sapere come vengono sintetizzati i poliesteri; B) saperlo. Le cose funzionano così. Per fare i poliesteri per prima cosa si parte da due componenti. Se hai letto la pagina dei poliesteri saprai che sono fatti di glicole etilenico e dimetilterftalato Se li vuoi vedere in 3D clicca qui.
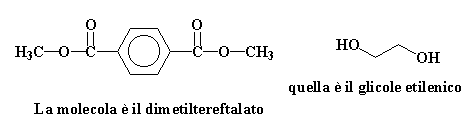
Accade qualcosa di divertente, quando queste due molecole si incontrano. Vedi, il dimetil-terftalato è un estere ,il glicole etilenico è un alcol. Quando gli alcoli e gli esteri si incontrano iniziano una sorta di ballo che viene detto reazione di trans-esterificazione.
Questo è uno di quei balli dove si va avanti scambiandosi i partner. Guarda un pò quei gruppi Metossi (in rosso) sul dimetiltrftalato, e i gruppi idrossietossilici (in blu) sul glicole etilenico. Quei gruppi si stanno posizionando come mostrato nella figura di sotto. L'idrossietossile finisce sull'estere, dove era presente il gruppo metossilico. Quest'ultimo va ad attaccarsi al'idrogeno ,dove c'era il gruppo idrossietossilico.
La parola idrossietossi è divertente da dire, non trovi? Prova!
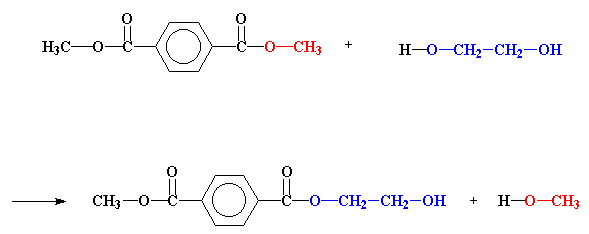
Quest'è quel che succede nel primo passo della sintesi per fare un poliestere. Diamo un'occhiata a come ciò accade.
Il posto importante su cui soffermarci è l'estere, il dimetiltereftalato. In particolare guarda il carbonio del carbonile. Nota che è legato con un doppio legame all'ossigeno.L'ossigeno è più elettronegativo del carbonio così succhierà via elettroni dal carbonio. Questo lascia una parziale carica positiva sul carbonio . Ciò significa che può essere facilmente attaccato da una coppia di elettroni che arriva da fuori.
Da dove dovrebbe arrivare la coppia di elettroni?
Quando c'è una alcol vicino, come il glicole etilenico, le coppie di elettroni non condivisi sull'ossigeno alcolico ruba gli elettroni simpaticamente. Questo attacca pro prio come nella figura sotto
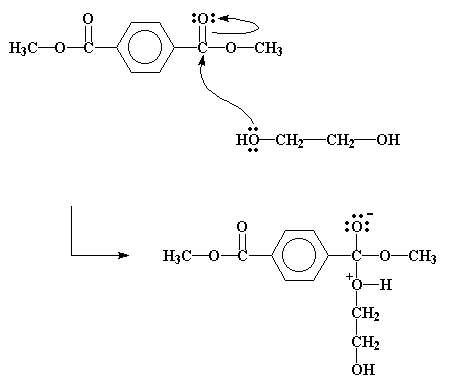
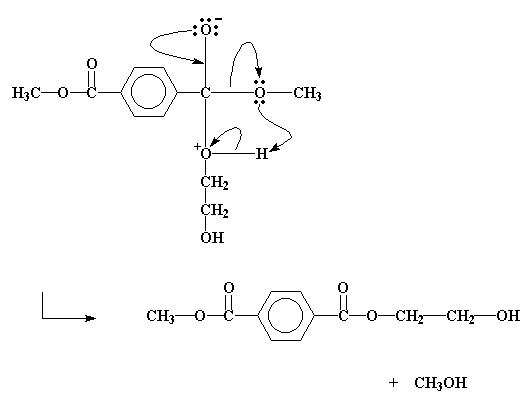
Questo spinge una coppia di elettroni del doppio legame carbonio-ossigeno a passare dal legame all'ossigeno del carbonile, portandogli una carca negativa. Questo significa che l'ossigeno dell'alcol acquista una carica positiva. Questo intermedio fa riarrangiare alcuni suoi elettroni come mostrato dalla freccia nella figura soprastante. Il risultato finale di questi spostamenti è che il gruppo idrossietilico del glicole finisce attaccato all'estere ed il gruppo metile dall'estere viene calciato via sotto forma di molecola di metanolo.
E cosi accade che i gruppi metilico ed idrossietilico finiscano per scambiarsi di posto
Quel metanolo è un sottoprodotto. Non lo vogliamo attorno. Se conduciamo la reazione ad una temperatura abbastanza alta , il metanolo evaporerà via.Questo è un bene. Non ci liberiamo solo del metanolo ma togliendo il prodotto questa reazione sposta la transesterificazione verso alte conversioni. Ricordi il principio di LeChatelier
Se vuoi vedere un filmato della reazione di transesterificazione, clicca qui.
La stessa reazione accade dall'altra perte del tereftalato e ci dà il bis-(2-idrossietil)tereftalato
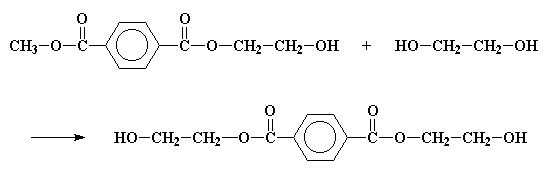
Se vuoi vedereil bis-(2-idrossietil)tereftalato in 3D clicca qui.
Dopo che noi abbiamo creato il bis-(2-idrossietil)tereftalato si fanno ancora un po di reazioni. Ma queste reazioni sono facili da seguire poichè sono tutte transesterificazioni simili a quella che hai appena visto. Dai un'occhiata. Questa molecola è sia un alcol, sia un estere. Così essa può transesterificare se stessa come la figura sotto evidenzia.
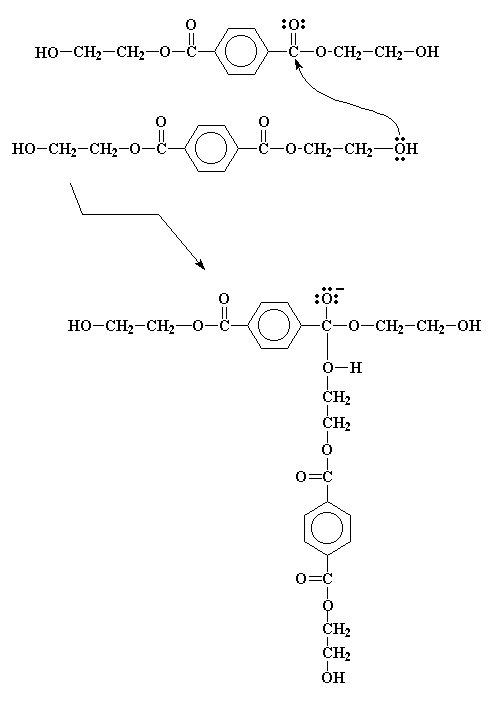
Si forma un intermedio simile a quellp visto poco fa e, senza novità, va incontro ad un uguale spostamento di elettroni per ottenere il prodotto che vediamo nella figura figura qui sotto.
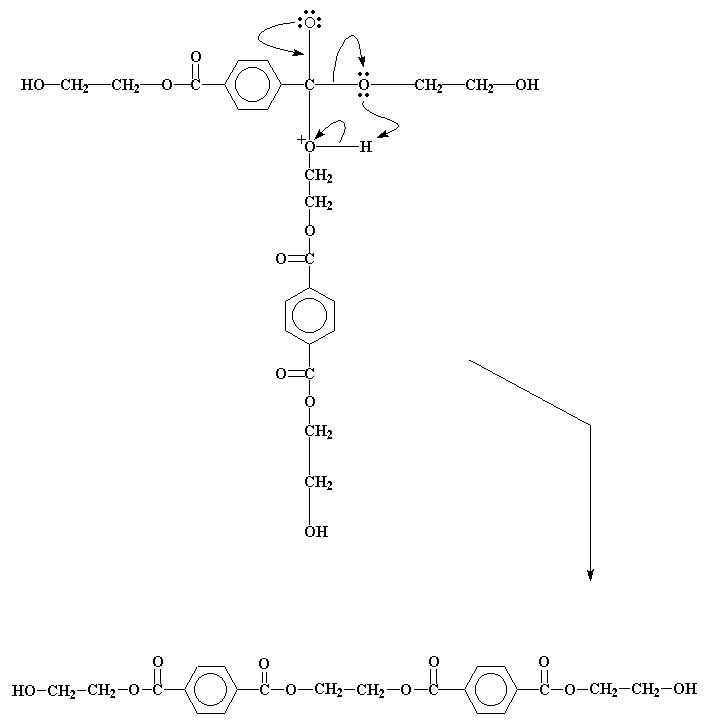
Questo prodotto può reagire di nuovo proprio comeil bis-(2-idrossietil)tereftalato. Non appena succede, la molecola formata diventa sempre più grande fino ad ottenere il PET ad alto peso molecolare
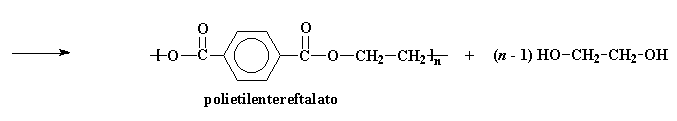
 Ritorna
alla Pagina del Poliestere
Ritorna
alla Pagina del Poliestere
 Ritorna
all'Indice del Quarto Piano
Ritorna
all'Indice del Quarto Piano
 Ritorna
all'Indice della Macrogalleria
Ritorna
all'Indice della Macrogalleria