

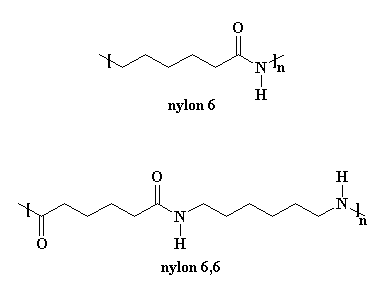
Но изготовление найлона 6 весьма сильно отличается от изготовления найлона 6,6. Во-первых, найлон 6 делается только из одного типа мономера, а именно мономера под названием капролактам. Найлон 6,6 получают из двух мономеров, адипоилхлорида и гекасаметилендиамина.
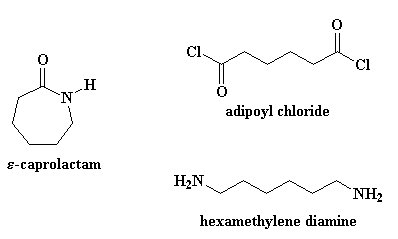
Но хватит болтать о пустяках. Давайте займемся настоящим делом, превращением капролактама в найлон 6. Найлон 6 получают при нагревании примерно до 250 oC в присутствии примерно 5-10% воды. И что же происходит с капролактамом, когда поблизости оказывается немного воды? Атом кислорода из карбонильной группы смотрит вокруг, видит рядом молекулу воды и понимает, насколько легко ему будет украсть у этой молекулы один из атомов водорода. И как часто случается, это небольшое событие, которое на первый взгляд выглядит достаточно безобидно, может перерасти в нечто значительно более масштабное. Если вы внимательно понаблюдаете, то вы увидите, что жадность капролактама постепенно охватит его целиком и подчинит его себе.
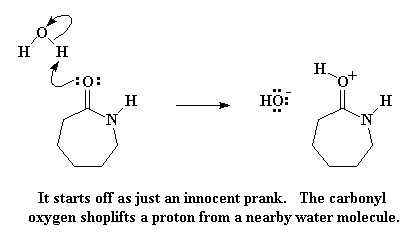
Этот атом кислорода в карбонильной группе выступает в роли донора, то есть передает пару электронов атому водорода из молекулы воды, но таким образом он крадет этот атом водорода у воды. При этом образуются протонированный карбонил и свободная гидроксильная группа. Не забывайте про эту гидроксильную группу, поскольку она еще вернется и не будет давать покоя старому жадному капролактаму. Но сначала давайте вспомним о том, что атом кислорода в карбонильной группе теперь обладает положительным зарядом. Ему это не нравится, поэтому он утаскивает пару электронов у карбонильной двойной связи, оставляя положительный заряд на атоме углерода карбонильной группы.
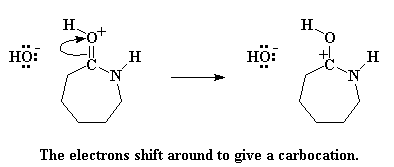
Но карбкатионы никогда еще не были счастливы. Если вы создаете карбкатион в молекуле, то вы просто сами напрашиваетесь на то, что какой-нибудь нуклеофил, случившись рядом, атаковал его. Нуклеофил? Кто-то сказал нуклеофил? Мне кажется, что у нас уже есть один такой поблизости. Это то самый старый ион гидроксила, который остался, когда капролактам украл протон у молекулы воды. Этот ион гидроксила так и не справился со своими отрицательными эмоциями по поводу потери протона, украденного капролактамом. И, затаив немалую злобу, он атакует карбкатион.
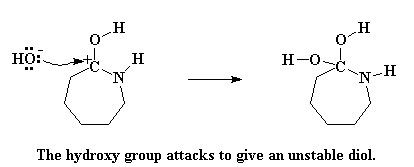
Образованная молекула называется "неустойчивый" gem диол. Неустойчивый? Конечно же. Разве я вам не говорил о том, что жадность капролактама приведет к его гибели? Затем происходит безумная перестройка электронов. Атом азота дарит пару электронов атому водорода в одной из гидроксильных групп, таким образом перетаскивая его к себе. Электроны, которые тот атом водорода делил с атомом кислорода смещаются, образуя двойную связь между этим атомом кислорода и атомом углерода. И, в конце концов, электроны, которые атом углерода делил с атомом азота, полностью смещаются в сторону азота, что приводит к разрыву связи между атомами азота и углерода.
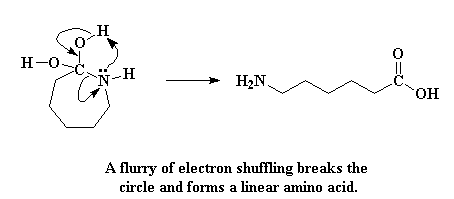
Увы, круг разорван, и нет больше капролактама! Как и многие торговцы бросовыми акциями в восьмидесятые годы, он дорого заплатил за свою жадность. Все, что у нас осталось - это линейная аминокислота.
Но наша история еще далеко не закончилась. Видите ли, линейная аминокислота может провзаимодействовать с молекулой капролактама, точно так же, как это в свое время сделала молекула воды. Молекулы капролактама не слишком сообразительны. Даже будучи свидетелями того, как одна из них погибла из-за собственной жадности, они сами не становятся менее жадными. Они просто пытаются украсть у своего павшего сородича все, что /только могут. Бедные жалкие глупцы! Всегда терзаемая приступами жадности, молекула капролактама утащит атом водорода у линейной аминокислоты. Атом кислорода из карбонильной группы подарит этому атому водорода пару электронов и украдет его таким образом у аминокислоты.

Как и ожидалось, электроны перестроятся, образовав карбкатион, точно так же, как и раньше:
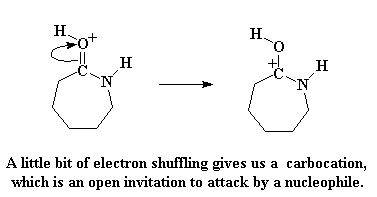
Это карбкатион все еще является легкой добычей для любого нуклеофила, который окажется поблизости, но на этот раз ему повстречается другой нуклеофил. Это та самая аминокислота, которая только что лишилась своего кислотного атома водорода. И у нее полно враждебности по отношению к вороватому капролактаму, поэтому она атакует его точно так же, как это ранее делал ион гидроксила, что мы уже наблюдали.
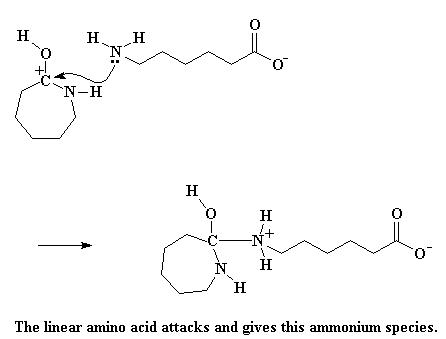
Это дает нам молекулу, содержащую аммоний, причем этот конкретный экземпляр очень нестабилен. Электроны продолжают играть в игру под названием "один лишний". Не проявляя ни малейшей лояльности, атом азота, входящий в состав цикла, крадет атом водорода у атома азота, входящего в состав аммония. Кроме того, разрывается связь между атомами азота и углерода, так что цикл раскрывается. Другая молекула капролактама попалась на ту же удочку и теперь кусает локти.
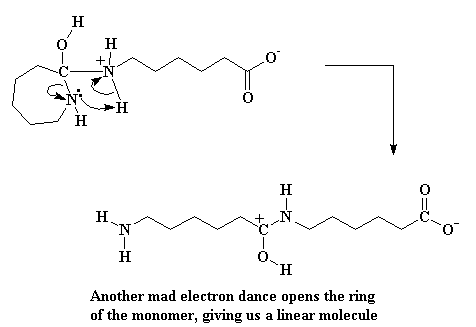
На мы еще не закончили. Эта карбоксильная группа на конце молекулы пройдется по своим соседям и стащит атом водорода у спиртовой группы.

Это создает новую карбонильную группу в середине молекулы и восстанавливает карбоксильную кислоту. (Вот здесь есть маленький секрет: никто на самом деле не знает, в каком точно порядке происходят эти два последних шага. Они могут случиться и в обратном порядке. Мы знаем точно только то, что они оба должны произойти, прежде чем все закончится.) Если вы хотите посмотреть фильм об всем процессе роста макромолекулы в целом, нажмите сюда. (Не забывайте, что это реакция поликонденсации.)
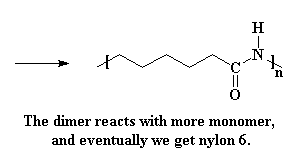
Теперь, когда у нас снова есть кислота, она наверняка провзаимодействует с другой жадной молекулой капролактама, а затем еще с одной, потом со следующей и так далее, пока мы не получим длинные цепочки найлона 6.
 Вернуться на страницу Найлоны
Вернуться на страницу Найлоны Вернуться в директорию
Четвертого Уровня
Вернуться в директорию
Четвертого Уровня Вернуться
в основную директорию Макрогалереи
Вернуться
в основную директорию Макрогалереи