

La polimerización vinílica catiónica es una forma de obtener polímeros a partir de moléculas pequeñas, o monómeros, que contengan dobles enlaces carbono-carbono. Su empleo comercial principal es para sintetizar poliisobutileno.
En la polimerización vinílica catiónica, el iniciador es un catión, es decir, un ion con carga eléctrica positiva. En la figura se muestra como A+. Este catión atraerá un par de electrones, con carga negativa, del doble enlace carbono-carbono y por lo tanto se formará un enlace simple con el iniciador, tal como se muestra. Esto deja deficiente de electrones a uno de los carbonos que estaban comprometidos en el doble enlace, portando una carga positiva. Este nuevo catión va a reaccionar con una segunda molécula de monómero, del mismo modo que hizo el iniciador cuando reaccionó con el primer monómero. El proceso ocurre una y otra vez, hasta que se alcanza un alto peso molecular, lo suficiente como para que el polímero pueda prestarnos alguna utilidad.
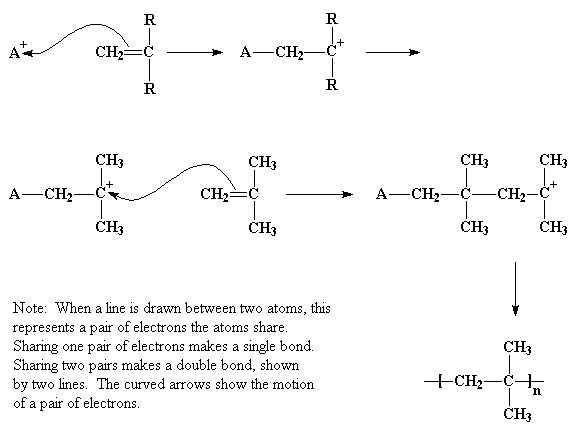
Muchas veces, sin embargo, ésto comienza de una manera un poco más complicada. Normalmente, el iniciador empleado es tricloruro de aluminio, o AlCl3. Si usted conoce la regla del octeto, sabrá que todos los átomos del segundo período de la tabla periódica buscan tener 8 electrones en su capa o nivel externos. El átomo de aluminio en el AlCl3 comparte pares de electrones con otros tres átomos, por lo que queda con apenas 6 electrones, dos menos del mágico octeto. No obstante, tiene un orbital completo (es decir, un lugar vacante donde debería haber electrones) que está vacío y listo para ser ocupado. Y justamente lo que ocurre, para gran delicia de ese átomo de aluminio, es que por lo general, una pequeña cantidad de agua se encuentra presente en el sistema. Entonces el átomo de oxígeno del agua, que tiene dos pares electrónicos no compartidos, gustosamente dona uno de ellos al átomo de aluminio, formando un complejo entre el AlCl3 y el H2O.
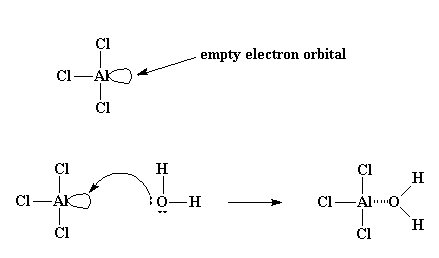
Al ser extremadamente electronegativo, el oxígeno tratará de atraer hacia sí mismo los electrones que comparte con los átomos de hidrógeno, dejando a éstos con una ligera carga positiva. Por lo tanto, se crea una situación propicia para el ataque de un par de electrones proveniente del doble enlace de la molécula monomérica. Así, el monómero podrá tomar un hidrógeno, convertirse en catión y el complejo AlCl3/H2O se transforma en su anión complementario, AlCl3OH-. Este proceso, por el cual se forma el complejo AlCl3/H2O y reacciona con la primera molécula de monómero, se denomina iniciación.
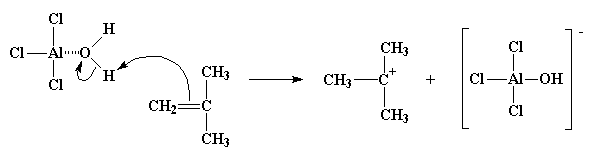
Como podrá apreciar, ahora tenemos un nuevo catión. Más que catión, un carbocatión. Así lo llamamos por poseer la carga positiva sobre un átomo de carbono. Los carbocationes son sumamente inestables, porque el átomo de carbono sólo posee 6 electrones en su capa externa. ¡Seis! O sea dos electrones menos de los que todo átomo de carbono desea poseer en su capa externa. Por lo tanto un carbocatión hará todo lo posible para ganarse esos dos electrones que le faltan y alcanzar el mágico octeto.
De modo que el carbocatión mira a su alrededor y encuentra un par de electrones en el doble enlace de la molécula monomérica más cercana. (Recuerde que en un doble enlace, existen dos pares de electrones). Entonces el carbocatión toma esos electrones y al hacerlo, establece un enlace simple con la molécula de monómero. Esto también genera otro carbocatión, como usted observa en la figura de abajo, que a su vez puede reaccionar con otro monómero, luego con otro y así sucesivamente. Finalmente, obtenemos una larga cadena polimérica.
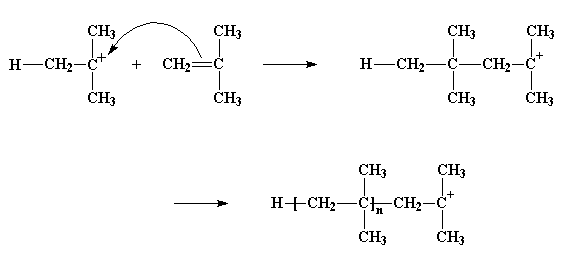
El proceso por el cual se agrega un monómero atrás de otro dando origen a un polímero, se denomina propagación.
¿Pero cómo termina? ¿Cuándo se detiene este ciclo de agregar más moléculas de monómero al polímero en crecimiento? El modo más común es algo como ésto... Imagine la cadena en crecimiento de poliisobutileno. Los grupos metilo unidos al átomo de carbono catiónico tienen un pequeño problema: sus hidrógenos. Esos hidrógenos no tendrán inconvenientes en separarse y unirse a otras moléculas. Esto es justamente lo que puede suceder cuando se acercan a una molécula de monómero isobutileno. Avidos de electrones como están por ser parte de un catión, estos hidrógenos son fácilmente atacados por un par de electrones proveniente del doble enlace de la molécula de isobutileno. Cuando todos los electrones se hayan reordenado, como muestran las flechas, nos quedaremos con una cadena polimérica neutra que contiene un doble enlace terminal y un nuevo catión, formado a partir de la molécula de isobutileno. El extremo de la cadena ahora será neutro y ya no podrá reaccionar para seguir creciendo. Pero el nuevo catión puede comenzar una nueva cadena en crecimiento, del mismo modo en el que lo hizo nuestro iniciador. Este proceso se denomina transferencia de cadena. Ocurre además en una polimerización por radicales libres, como así también en otras clases de polimerización.
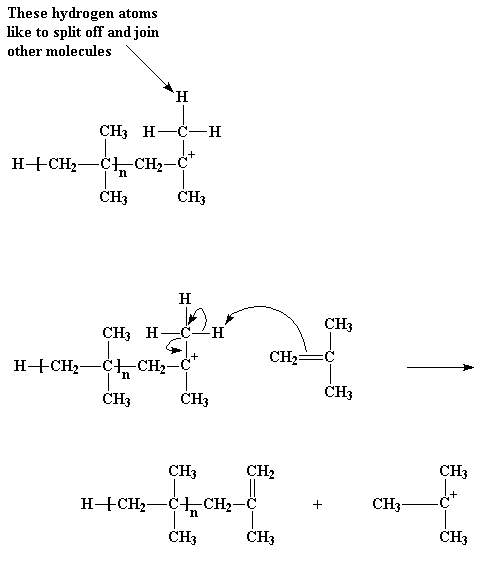
Ese tipo particular de transferencia de cadena se llama transferencia de cadena al monómero. Pero existe otra clase de transferencia. Para comprenderlo, debemos recordar que para cada catión, en el mismo beaker existe un anión acechando en alguna parte. ¿Se acuerda del ion AlCl3OH-? Tal como todos sabemos, cationes y aniones tienen esa molesta tendencia a reaccionar entre sí, lo cual puede ser problemático cuando deseamos que nuestro catión reaccione con alguna otra cosa, como por ejemplo una molécula de monómero. Veamos cómo ocurre.
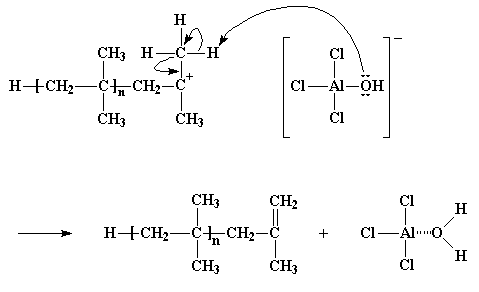
Cuando reacciona el iniciador catiónico y forma una cadena catiónica en crecimiento, el anión del mismo pasa a ser el anión del catión polimérico en crecimiento. Recuerde que los aniones tienden a poseer pares de electrones flotando a su alrededor sin nada que hacer y eso puede ser muy inconveniente. Esto es justamente lo que ocurre aquí. Los electrones del anión, de vez en cuando, atacarán los átomos de hidrógeno de los grupos metilo adyacentes al carbono catiónico. ¿Se acuerda de estos átomos de hidrógeno? Son los que estaban tan ansiosos de ser secuestrados por una molécula monomérica cercana. A veces, no a menudo pero sí a veces, estos hidrógenos reaccionan muy fácilmente y de la misma manera, con los electrones no compartidos del átomo de oxígeno del anión, dejando a la moribunda cadena polimérica con un doble enlace terminal. Pero por otro lado, el complejo AlCl3/H2O es regenerado y puede comenzar a producir nuevos polímeros crecientes, tal como lo había hecho antes. Y no es nada más que otro curioso caso de transferencia de cadena.
Claro que no todo sale siempre tan bien. A veces, el que reacciona es el par de electrones no compartidos del átomo de cloro, y no con uno de los átomos de hidrógeno, sino con el mismo átomo de carbono catiónico. Este abandona el contraión y se une al polímero. Y entonces nos quedamos con otra clase distinta de polímero inactivo, que termina con un átomo de cloro y con AlCl2OH, que no va a iniciar ninguna nueva cadena en crecimiento.
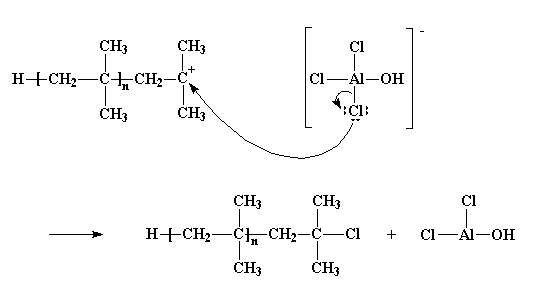
Este proceso se denomina terminación, porque no se inicia ninguna cadena. Es la última de las tres etapas principales en cualquier polimerización por crecimiento de cadena, en la cual las dos primeras son, obviamente, la iniciación y la propagación. Cuando la terminación toma lugar, la polimerización se da por concluida.

 Volver al Directorio del Nivel Cuatro
Volver al Directorio del Nivel Cuatro Volver al Directorio de Macrogalleria
Volver al Directorio de Macrogalleria