

Ключевые слова
электролит,
ион,
случайный клубок.
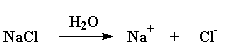
Полиэлектролиты - это полимеры, которые ведут себя точно так же. Они распадаются в воде. Не хотите ли взглянуть? А как насчет полиакриловой кислоты? Положите это вещество в воду, и атомы водорода отделятся от своих кислотных групп и присоединятся к молекулам воды, образуя таким образом ионы H3O+:


Но когда макромолекулы покрыты отрицательными зарядами (которые отталкивают друг друга), полимер не может скрутиться в клубок. Поэтому макромолекула вытягивается в длину, вот так:

Это делает раствор (как вы помните, мы ведем речь о полиэлектролитах в растворе) более вязким. Подумайте сами: когда макромолекула выпрямляется, она занимает больше места и за счет этого гораздо эффективнее тормозит движение молекул растворителя вокруг нее. Поэтому раствор становится густым и похожим на сироп.
Но существует способ, которым вы можете предотвратить это. Если взять раствор полиэлектролита в воде и добавить в него большое количество соли, то произойдет нечто любопытное. NaCl разделится на ионы Na+ и Cl-. В случае отрицательно заряженного электролита (как, например, полиакриловая кислота) положительно заряженные ионы натрия могут расположиться между отрицательными зарядами, и таким образом компенсировать их. Когда это произойдет, макромолекула снова свернется в случайный клубок.

Что? Вы мне не верите? Помните, я говорил, что вы сами можете это сделать. И сейчас я вам скажу, как именно это можно сделать. Возьмите гель для волос и положите большой кусок его в миску. Теперь возьмите солонку и сыпьте на него соль, как если бы вы хотели, чтобы кровяное давление у вашей бабушки подскочило выше крыши. Когда вы сделаете это, гель превратится во вполне обычную и скучную жидкость. Вот как существенно может измениться вязкость при сворачивании макромолекул в клубки!
 Вернуться в директорию Третьего Уровня
Вернуться в директорию Третьего Уровня Вернуться
в основную директорию Макрогалереи
Вернуться
в основную директорию Макрогалереи