

Mots clés
amorphe, copolymère, entropie, liaison hydrogène
Les Polymères ne se mélangent pas
Faire des Mélanges de Polymères
Faire vos Propres Mélanges
Propriétés des Mélanges
Se Mélanger ou ne pas se Mélanger
Quelques fois nous avons besoin d'un matériau qui a certaines propriétés d'un polymère et certaines propriétés d'un autre polymère. Au lieu de retourner au laboratoire et de fabriquer un nouveau polymère avec toutes les propriétés dont nous avons besoin, nous essayons de mélanger deux polymères, dans l'espoir d'avoir les propriétés de chacun des deux.
Cela semble assez facile, mais il s'avère que mélanger deux polymères différents est généralement une affaire assez délicate. Il est en effet très rare que deux types de polymères se mélangent. Cela semble incroyable.
Regardez le polyéthylène et le
polypropylène: 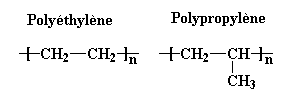
Pouvez-vous imaginer que ces deux polymères ne se mélangent pas? Pourquoi? Ce sont deux polymères hydrocarbonés absolument pas polaires. Ils devraient se mélanger facilement.
 Et bien non. Et il y a une
raison. Le responsable est cette bonne vieille entropie. Entropie est le
nom que les scientifiques donnent au désordre. Cette chienne s'appelle Entropie.
Dites simplement "Frisbee" à côté d'elle et vous aurez un bonne
démonstration de ce qu'est l'entropie.
Et bien non. Et il y a une
raison. Le responsable est cette bonne vieille entropie. Entropie est le
nom que les scientifiques donnent au désordre. Cette chienne s'appelle Entropie.
Dites simplement "Frisbee" à côté d'elle et vous aurez un bonne
démonstration de ce qu'est l'entropie.
Cela nous amène à une petite règle que nous appelons la seconde loi de la thermodynamique. Cette loi dit que quand les choses changent, elles passent d'un état d'ordre à un état de désordre. Faire changer les choses dans l'autre sens est très difficile. Il est facile de mettre votre chambre en désordre, difficile de la ranger. Il est facile de casser une voiture, difficile de la remettre en état. Un changement dans votre chambre, dans votre vie, dans un polymère a plus de chance de se produire s'il amène à un état de plus grand désordre que s'il amène à un état plus ordonné; c'est-à-dire qu'un changement a plus de chance de se produire s'il provoque une augmentation de l'entropie.
Qu'est-ce que l'entropie a à voir avec les mélanges de polymères? Nous allons vous donner quelques explications. Considérez un polymère amorphe. Quand il est seul, les chaînes sont emmêlées les unes dans les autres au hasard et de façon chaotique. L'entropie est élevée dans un polymère amorphe.
Cela pose un problème si vous essayez de faire des mélanges de polymères. L'une des principales raisons qui font que deux polymères se mélangent, c'est qu'ils sont plus désordonnés une fois mélangés que lorsqu'ils sont séparés. Donc le mélange est favorisé par la seconde loi de la thermodynamique. Mais un polymère amorphe est déjà si désordonné qu'il ne peut pas gagner beaucoup d'entropie quand il est mélangé à un autre polymère. Donc le mélange n'est pas favorable.
C'est donc un challenge de mélanger des polymères. Sans l'aide de l'entropie comment faire pour mélanger deux polymères? Il faut retourner à la première loi de la thermodynamique. Aha! Comme les avocats, nous pouvons utiliser une loi pour en contourner une autre. La première loi de la thermodynamique nous dit que quand les choses changent, elles changent vers un état de plus faible énergie. On peut voir ça comme ça: il est plus facile d'aller se coucher que de se lever le matin. Si vous voulez un exemple plus physique, un rocher en haut d'une montagne roulera plus facilement en bas qu'un rocher en bas de la montagne ne roulera en haut. (J'ai appris ça quand je faisais de l'escalade et que j'ai failli être tué par une chute de pierre).
Qu'a donc à voir la première loi de la thermodynamique avec les mélanges de polymères? Ceci: pour que deux polymères se mélangent il faut qu'ils aient moins d'énergie une fois mélangés que lorsqu'ils sont séparés. Utilisons un exemple pour illustrer ce que nous disons. Parmi les couples de polymères qui se mélangent effectivement, on a le
polystyrène et le polyphénylène oxyde. 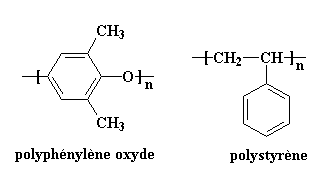
Comme vous pouvez le voir, ces deux polymères ont des cycles aromatiques. Comme vous le savez peut-être, les cycles aromatiques aiment s'empiler. Pour cette raison ces deux polymères aiment s'associer, et se mélangent très bien. Il y a peu d'autres exemples de paires de polymères qui se mélangent. Voici une petite liste:
polyéthylène téréphthalate avec polybutylène téréphthalate
polyméthacrylate de méthyle avec polyfluorure de vinylidène
Copolymères
Mais la plupart du temps, les deux polymères que vous souhaiteriez mélanger ne sont pas miscibles. Il va falloir leur jouer quelques tours pour les rendre miscibles. L'une des possibilités est d'utiliser des copolymères. Le polystyrène ne se mélange pas avec beaucoup de polymères, mais si l'on utilise un copolymère fait de styrène et de p-(hexafluoro-2-hydroxyisopropyle)styrène, le mélange devient possible.
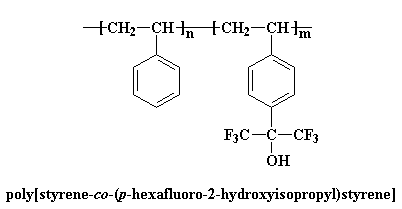
Voyez-vous, les atomes de fluor sont très électronégatifs, et ils attirent les électrons des atomes avoisinants. Cela rend l'hydrogène du groupe alcool très déficitaire en électrons, ce qui veut dire qu'il a une charge partiellement positive. Et donc l'hydrogène va former des liaisons hydrogène très fortes avec tous les groupes qui ont une charge positive. Il devient donc facile de mélanger ce copolymère à des polycarbonates, polyméthacrylate de méthyle, et polyacétate de vinyle.2,3
Il existe une autre façon d'utiliser les copolymères pour faciliter les mélanges de polymères. Considérons un copolymère statistique de styrène et d'acrylonitrile. Ce copolymère peut se mélanger au polyméthacrylate de méthyle (PMMA). C'est là que ça devient bizarre.Le PMMA ne se mélange ni avec le polystyrène ni avec le polyacrylonitrile.
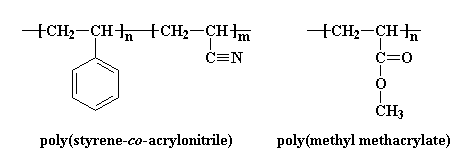
Alors pourquoi notre copolymère statistique se mélange-t-il avec le PMMA? L'explication est quelque chose comme ça: les segments de styrène et d'acrylonitrile du copolymère statistique peuvent ne pas aimer le PMMA, mais ils s'aiment encore moins l'un l'autre. Les segments de styrène sont non polaires alors que les segments acrylonitrile sont très polaires. Les segments de styrène et les segments d'acrylonitrile se mélangent au PMMA pour éviter d'avoir à entrer en contact les uns avec les autres.
Il existe deux façons de faire les mélanges. La première façon consiste à dissoudre deux polymères dans le même solvant, et d'attendre que le solvant s'évapore. Quand le solvant s'est tout évaporé on a un mélange au fond de notre Becher, si toutefois les deux polymères sont miscibles.
Mais cette méthode est surtout valable en laboratoire, et serait très onéreuse si on l'utilisait industriellement. Les solvants ne sont pas bon marché, et si vous en faites évaporer des milliers de litres, cela va vous revenir cher. Sans parler des effets que cela pourrait avoir sur l'environnement si on fait évaporer autant de matière toxique dans l'air.
Par conséquent pour fabriquer des mélanges en grandes quantités, il vaut mieux chauffer les deux polymères jusqu'au-dessus de leurs
températures de transition vitreuse. Ils seront alors assez mous pour que vous puissiez les mélanger comme des pâtes à gâteaux. On fait souvent cette opération dans des extrudeuses. Quand le matériau refroidit on a un superbe mélange, en supposant au départ que les deux polymères soient miscibles.A quoi ressemblent ces mélanges? Comment se comportent-ils? En général un mélange de polymères miscibles aura des propriétés intermédiaires de celles de chacun des composants. Prenons par exemple la
température de transition vitreuse, ou Tg. Si on prend un polymère A et qu'on le mélange à un polymère B, la Tg va dépendre de la proportion de polymère A par rapport au polymère B dans le mélange. Vous pouvez voir cela sur la courbe ci-dessous. 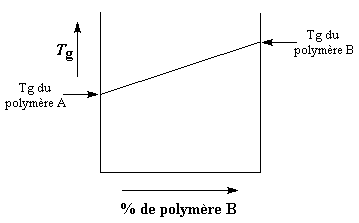
Si le polymère B a une Tg plus haute que le polymère A, la Tg du mélange va augmenter avec la quantité de polymère B dans le mélange. L'augmentation est généralement linéaire, comme vous le voyez sur la courbe. Mais en fait la courbe n'est pas parfaitement linéaire. Parfois si les deux polymères se lient plus fortement entre eux qu'avec eux-mêmes, la Tg sera plus haute que prévue, car la mobilité des chaînes se trouvera réduite. La courbe ressemblera à celle de droite sur la figure ci-dessous.
. 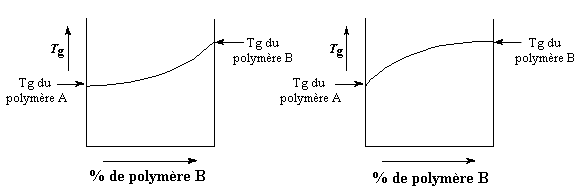
Bien sûr dans la plupart des cas les deux polymères se lient plus faiblement entre eux qu'avec eux-mêmes et la Tg du mélange est plus faible que prévu. La courbe ressemblera à ce que l'on voit à gauche ci-dessus.
Nous avons parlé jusqu'à présent de la température de transition vitreuse, mais ce qui est valable pour Tg l'est en général aussi pour les autre propriétés: les propriétés mécaniques, la résistance aux produits chimiques, aux radiations, à la chaleur. Les courbes ont en général la même allure que celle de la température de transition vitreuse par rapport aux quantités relatives de chaque polymère dans le mélange.
Cela fait que la modification des propriétés d'un mélange est assez simple. Si vous faites varier les quantités relatives de chaque polymère vous faites varier les propriétés. Cela peut être très utile. Prenons l'exemple du polyphénylène oxyde (PPO). Le PPO est un polymère très résistant à la chaleur. C'est fantastique. Les gens ont besoin de polymères résistants à la chaleur. Mais cela a également quelques inconvénients. Le PPO est très difficile à mettre en œuvre. Il est trop résistant à la chaleur. Les polymères amorphes sont généralement mis en œuvre au-dessus de Tg, pour qu'ils soient mous et visqueux. Mais avec une Tg de 210°C, chauffer suffisamment le PPO est non seulement difficile mais très cher.
Et voici le polystyrène! Rappelez-vous, le polystyrène et le PPO se mélangent très bien. Comme le polystyrène a une Tg de environ 100°C, mélanger le PPO avec le polystyrène permet d'abaisser la température de transition vitreuse et d'avoir un matériau plus facile à travailler.
Et maintenant un information intéressante: le NorylTM, le mélange PPO/polystyrène que vend GE, est fabriqué en utilisant un type de polystyrène spécial appelé polystyrène choc (HIPS: high-impact polystyrene). Le HIPS est un mélange de polystyrène et de polybutadiène. Ces deux polymères ne se mélangent pas. Le polybutadiène, qui est un caoutchouc, se sépare du polystyrène. Et les petites billes de polybutadiène rendent le polystyrène choc, et le NorylTM beaucoup plus tenaces. Un mélange qui forme des phases séparées s'appelle un mélange non miscible. Les mélanges non miscibles ne sont en fait pas du tout des mélanges, puisqu'ils se séparent comme l'eau et le gras de poulet dans un bouillon de soupe. Mais ce type de mélanges est cependant utile. Si vous voulez en savoir plus allez visiter la Page des mélanges de Polymères non Miscibles.
Quelques couples de polymères se mélangent . La plupart non. Mais il y a aussi des couples qui parfois se mélangent et parfois non. Les variables que l'on peut contrôler pour les rendre ou non miscibles sont en général la température et la composition. Beaucoup de couples de polymères sont miscibles seulement quand il y a beaucoup plus d'un des polymères que de l'autre. Il y aura une gamme de compositions pour lesquelles les polymères ne se mélangeront pas. Prenons par exemple un polymère A et un polymère B. Disons qu'ils sont miscibles quand on a moins de 30% de polymère B, ou plus de 70% de polymère B. Mais entre 30 et 70%, le mélange se sépare en deux phases. Voici un graphe pour ceux d'entre vous qui aiment ça:

Il est intéressant de noter qu'une des phases contiendra 30% de B et l'autre 70% de B. Il y a une raison à cela. Si on regarde une courbe de l'énergie libre en fonction de la composition, nous verrons que ces deux compositions ont des énergies plus basses que toutes les autres compositions.4 Une remarque: nous autres chimistes utilisons généralement la lettre grecque f pour représenter la quantité relative de l'un ou l'autre composant d'un mélange, donc nous utiliserons fB au lieu de "% B" à partir de maintenant.
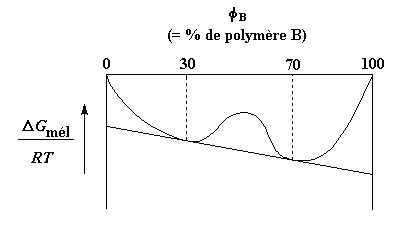
Ce sont donc les compositions les plus stables, et tout mélange entre 30 et 70% de polymère B va se séparer en deux phases, l'une contenant 30% de B et l'autre 70% de B.
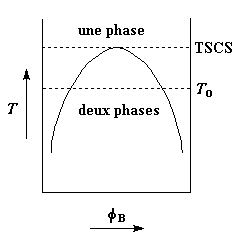 Mais l'intervalle de composition
dans lequel les deux polymères forment des phases n'est pas constant. Il peut changer
avec la température. Pour certains couples de polymères, cet intervalle devient plus
petit quand la température augmente. Finalement, si vous chauffez suffisamment ce type de
couples, la zone d'immiscibilité devient si petite qu'elle disparaît. La température à
laquelle cela se produit s'appelle température de solution critique supérieure
(TSCS). C'est ce qu'on voit sur le graphique de droite. La parabole renversée est la
limite entre les température et compositions auxquelles il y a une phase et celles
auxquelles il y a deux phases.
Mais l'intervalle de composition
dans lequel les deux polymères forment des phases n'est pas constant. Il peut changer
avec la température. Pour certains couples de polymères, cet intervalle devient plus
petit quand la température augmente. Finalement, si vous chauffez suffisamment ce type de
couples, la zone d'immiscibilité devient si petite qu'elle disparaît. La température à
laquelle cela se produit s'appelle température de solution critique supérieure
(TSCS). C'est ce qu'on voit sur le graphique de droite. La parabole renversée est la
limite entre les température et compositions auxquelles il y a une phase et celles
auxquelles il y a deux phases.
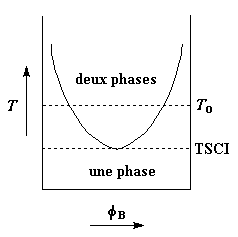 Mais quelques fois c'est l'inverse
qui se produit. Pour certains couples de polymères la zone d'immiscibilité décroît
quand la température baisse. Si on refroidit un tel type de couple suffisamment, on
atteint une température pour laquelle la miscibilité devient totale. Cette température
est appelée température de solution critique inférieure (TSCI). Si l'on trace
la courbe de l'immiscibilité en fonction de la température, elle ressemble à une
inversion de la courbe précédente comme vous pouvez le voir sur la figure de gauche.
Mais quelques fois c'est l'inverse
qui se produit. Pour certains couples de polymères la zone d'immiscibilité décroît
quand la température baisse. Si on refroidit un tel type de couple suffisamment, on
atteint une température pour laquelle la miscibilité devient totale. Cette température
est appelée température de solution critique inférieure (TSCI). Si l'on trace
la courbe de l'immiscibilité en fonction de la température, elle ressemble à une
inversion de la courbe précédente comme vous pouvez le voir sur la figure de gauche.
Maintenant pour les thermodynamiciens qui se demandent ce qui arrive à la courbe de l'énergie libre en fonction de la composition lorsque l'on rencontre les points TSCI ou TSCS et que les polymères sont devenus miscibles pour toutes les compositions, voici un graphe qui le montre:
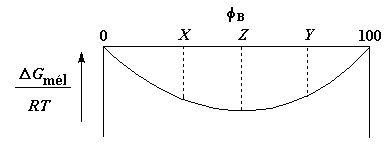
Cette courbe demande quelques explications. Imaginez un mélange de polymères A et B, de composition Z. Maintenant imaginez qu'il se sépare en deux phases, l'une de composition X, l'autre de composition Y. Comme vous le voyez les deux phases ont une énergie libre plus grande que le mélange de composition Z, et sont donc moins stables. Donc si par hasard la séparation de phases se produit, le mélange se remettra spontanément sous forme d'une phase de composition Z.
1. Ikawa, T.; Abe, K.; Honda, K.; and Tsuchida, E.; J. Polym. Sci., Polym. Chem. Ed., 1975, 13, 1505.
2. Ting, E. P.; Pearce, E. M. and Kwei, T. K., J. Polym. Sci. Polym. Lett. Ed., 1980, 18, 201.
3. Pearce, E. M.; Kwei, T. K. and Min, B. Y., J. Macromol. Sci. Chem., 1984, 21, 1181.
4. Coleman, M. M., Graf, J. F. and Painter, P. et al., Specific Interactions and the Miscibility of Polymer Blends, Technomic, 1991, p.20.
Copyright ©1998
| Department of Polymer Science | University of Southern Mississippi