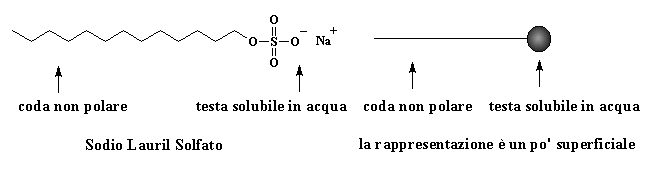
Rappresentazioni chimiche del Lauril Solfato di Sodio: coda non polare e testa solubile in acqua (la rappresentazione a destra è un po' sbrigativa!)
 Keywords
Keywords
La definizione di emulsione è: " Sospensione colloidale stabile come il latte, formata da un liquido immiscibile disperso e trattenuto in un altro liquido grazie ad una sostanza denominata emulsionante"
Per capire la polimerizzazione in emulsione e gli emulsionanti, dobbiamo prima capire come agisce il sapone. Si, il sapone! Se sapete già come funziona il sapone ed avete una ricetta della nonna per la soda caustica, cliccate qui per arrivare subito alla polimerizzazione in emulsione. Se siete curiosi continuate a leggere!
Le molecole di sapone soffrono di disturbi di personalità ma la loro doppia personalità è quasi sempre apparente. Un sapone, o tensioattivo come vie ne definito nella polimerizzazione in emulsione, ha due estremità di diversa solubilità. Un'estremità, chiamata coda, è un lungo idrocarburo solubile in composti organici non polari. L'altra, la testa, è spesso un sale di sodio potassio, solubile in acqua. Il sale solubile in acqua può essere il sale di un acido carbossilico o acido solfonico. Il termine tecnico per la dimostrazione chimica della "doppia personalità" è anfipatico.

Rappresentazioni chimiche del Lauril Solfato di Sodio: coda non polare e testa solubile in acqua (la rappresentazione a destra è un po' sbrigativa!)
Una sola molecola di sapone non è molto, ma quando si ha un gruppo di queste molecole tutte insieme, sta per accadere qualche cosa di particolare. Ad una determinata concentrazione le molecole di sapone nell'acqua si aggregano e formano micelle. Gli scienziati usano un nome adatto ( se non originale) ovvero concentrazione critica di micelle, CMC in forma abbreviata. Non lasciatevi ingannare dagli scienziati.

Qualsiasi particella di sporcizia o grasso che vi capita di avere sulle mani è simile ad un composto organico come questo:

Quando vi lavate le mani con acqua e sapone inizia il party. L'esultante particella di sporco salta proprio in mezzo dove è molto felice. Non vuole uscire per cui si dissolve nella coda organica della micella.
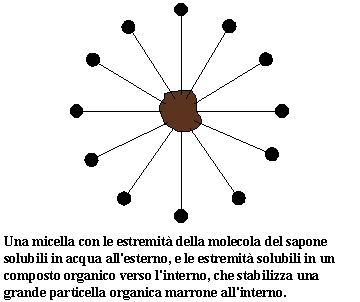
Lo sporco viene dissolto nella micella e la micella viene dissolta in acqua e ���Voilà. Con un'abbondante quantità di acqua potete eliminare ogni traccia di sporco e mandarla giù nel lavandino.
Ed ora una domanda per voi: perché è così difficile fare il bagno nell'oceano?
Nella polimerizzazione in
emulsione il sapone, o tensioattivo, viene dissolto nell'acqua fino a quando
viene raggiunta la concentrazione critica di micelle (CMC). L'interno delle
micelle è il luogo ideale per la polimerizzazione. Vengono aggiunti
un monomero (come stirene o metacrilato di metile) ed un iniziatore a radicale
libero, solubile in acqua e tutta la miscela viene rimescolata ed agitata
(scusa James Bond). Le polimerizzazioni in emulsione avvengono sempre per
via radicalica.
Le parti terminali delle catene anioniche e cationiche altrimenti verrebbero
immediatamente soffocate dall'acqua. Il prodotto di una polimerizzazione
in emulsione viene chiamata lattice; il termine idropitturanon vi fa venire
in mente qualche cosa?
Una volta gettato nel recipiente,
il monomero si può trovare in tre posti diversi. Può essere
in grandi gocce di monomero che fluttuano nell'acqua senza meta. Una parte
del monomero può essere dissolta nell'acqua ma è molto improbabile.
Ricordate che i monomeri organici come stirene e metacrilato di metile
hanno una paura terribile dell'acqua? Infine il monomero può trovarsi
nelle micelle ed è proprio dove lo vogliamo noi. Verificate la definizione
all'inizio della pagina. Il liquido immiscibile è il monomero idrofobo,
il liquido principale è l'acqua e l'emulsionante è il sapone.
L'iniziazione
avviene quando un frammento di iniziatore migra all'interno di una micella
e reagisce con una molecola di monomero. Di norma vengono utilizzati gli
iniziatori solubili in acqua, come i perossidi ed i persolfati (Inoltre
si evita la polimerizzazione nelle grandi gocce di monomero). Una volta
iniziata la polimerizzazione, la micella viene considerata come un aggregato
di catene polimeriche in crescita. Il peso molecolare di questi
aggregati polimerici può aumentare notevolmente, specialmente se
la concentrazione dell'iniziatore è bassa. Il tutto abbassa anche
la concentrazione dei radicali e la velocità di terminazione. Talvolta
viene aggiunto alla miscela un agente di trasferimento per far si che il
peso molecolare non aumenti troppo.
Il monomero migra dalle grandi
gocce alle micelle per sostenere la polimerizzazione. In media si ha un
radicale per micella. Per questo motivo non c'è grande competizione
per il monomero tra le catene in espansione all'interno delle particelle
cosicché queste crescono fino ad un peso molecolare quasi identico
e la polidispersione è molto vicina a uno. Praticamente tutto il
monomero viene consumato nelle polimerizzazioni in emulsione, ciò
significa che il lattice può essere utilizzato senza essere purificato.
Questo è molto importante per vernici e rivestimenti. Basta aggiungere
un po� di colore al lattice, versarlo in una latta ed è pronto per
l'uso.
Questo
è l'aspetto interessante della polimerizzazione in emulsione: ogni
micella può essere considerata come una mini polimerizzazione in
massa A differenza delle polimerizzazioni in massa tradizionali
tutto il monomero reagisce e non si formano "punti
di sovrariscaldamento". Nelle polimerizzazioni in massa (nessun solvente,
solo monomero ed iniziatore), i punti di sovrariscaldamento provocano degradazione
e colorazione ed il trasferimento delle catene amplifica la distribuzione
del peso molecolare. L'aumento di temperatura a volte provoca un aumento
della velocità della polimerizzazione in maniera esplosiva. L'acqua
in questo caso agisce come pozzo di calore per tutti questi mini reattori
ed evita loro di scoppiare! I piromani non amano la polimerizzazione in
emulsione!
Anche questo è favoloso!
La velocità della polimerizzazione è uguale alla velocità
della scomparsa del monomero. Il monomero scompare più velocemente
quando ci sono più particelle. Per avere più particelle è
necessario avere più micelle. Se la concentrazione della soluzione
di tensioattivo aumenta dovrebbe esserci un maggior numero di micelle.
Supponiamo che la concentrazione dell'iniziatore rimanga uguale. Si otterranno
più particelle e meno radicali, ciò significa che il numero
di radicali per gocce di micelle scende ad di sotto di uno. In altre parole
la velocità di terminazione rimarrà bassa fino a quando ci
sono pochi radicali. WHEW! Il risultato finale è questo: diminuendo
la concentrazione dell'iniziatore aumenta il peso molecolare e la velocità
di polimerizzazione! Tutto l'opposto della polimerizzazione in massa e
in soluzione. In questi casi per aumentare la velocità di polimerizzazione
è necessario fornire calore alla reazione o aumentare la concentrazione
dell'iniziatore, entrambe aumentano la velocità di terminazione
ed abbassano il peso molecolare.
Sembra
chiaro, ma è utile? Certo che lo è il polivinilacetato,
il policloroprene, i polimetacrilati,
il polivinilcloruro, la poliacrilammide ed i copolimeri
del polistirene, il polibutadiene
ed il poliacrilonitrile possono essere commercializzati
grazie alla polimerizzazione in emulsione.
Avete avanzato a fatica nello
sporco per arrivare fino qui, a meno che non siate scappati subito alla
fine per vedere cosa c'era di bello. Adesso sarete ricompensati da questa
tabella di indovinelli facili da decifrare che elenca i pregi e i difetti.
E infine�..la polimerizzazione in emulsione
Dove si trova?
Inizio e polimerizzazione
Propagazione
Peso molecolare
In parole povere
Congratulazioni!
| Processo di polimerizzazi | PREGI | Difetti |
| Massa | E' presente solo il monomero -nessun materiale aggiuntivo, Elevato peso molecolare | Punti di sovrariscaldamento, Elevata viscosità, presenza di monomoro che non ha reagito |
| Soluzione | Facile controllo della temperatura, Controllo del peso molecolare | E' necessario rimuovere il solvente Trasferimento di catene al solvente |
| Emulsione | Reagisce tutto il monomero. Il lattice può essere utilizzato così come si presente. Facile controllo termico Si possono ottenere materiali con bassa Tg ; Bassa viscosità | La presenza di tensioattivi che può causare sensibilità all'acqua |
 Ritorna
all'Indice del Quarto Piano
Ritorna
all'Indice del Quarto Piano
 Ritorna
all'Indice della Macrogalleria
Ritorna
all'Indice della Macrogalleria