

Palabras Claves
amorfo,
cristal,
elastómero,
termoplástico
Debemos aclarar algo en este punto. La transición vítrea no es lo mismo que el fundido. El fundido es una transición que se manifiesta en los polímeros cristalinos. Ocurre cuando las cadenas poliméricas abandonan sus estructuras cristalinas y se transforman en un líquido desordenado. La transición vítrea es una transición que se manifiesta en los polímeros amorfos; es decir, polímeros cuyas cadenas no están dispuestas según un ordenamiento cristalino, sino que están esparcidas en cualquier ordenamiento, aún en estado sólido.
Pero incluso los polímeros cristalinos tienen alguna porción amorfa. Esta porción generalmente constituye el 40-70% de la muestra polimérica. Esto explica por qué una misma muestra de un polímero puede tener tanto una temperatura de transición vítrea como una temperatura de fusión. Pero lo importante es saber que la porción amorfa sólo experimentará la transición vítrea, y la porción cristalina sólo la fusión.
Ahora, para entender por qué los polímeros sin ordenamiento alguno son duros y quebradizos por debajo de cierta temperatura, y blandos y flexibles por encima, sería útil imaginar un polímero en estado amorfo como una gran habitación repleta de serpientes escurridizas. Cada serpiente constituye una cadena polimérica. Según usted sabe, las víboras son animales de sangre fría, de modo que todo el calor de su cuerpo debe proceder de sus alrededores. Cuando hace calor, las víboras se encuentran a gusto y pueden deslizarse y escurrirse sin ningún tipo de inconvenientes. Se mueven totalmente al azar, por encima y alrededor de las demás, a entera satisfacción.
Pero cuando hace frío, las serpientes no se mueven demasiado. Se ponen más lentas en ausencia de calor y tienden a mantenerse quietas. Si bien permanecen enroscadas, una por encima de la otra, en lo que respecta a movimiento, éste no ocurre.
Ahora imagine que usted trata de conducir una topadora a través de esta habitación repleta de víboras. Si hace calor y las víboras están en movimiento, podrán apartarse rápidamente de su camino y la topadora avanzará por la habitación sin causar mayores daños a los animales. Pero si hace frío, pueden ocurrirles dos cosas a las inmóviles serpientes. O bien (A) son más fuertes que la topadora y le impedirán el paso, aún sin moverse; o bien (B) la topadora es más resistente que ellas y las aplastará, sin que tampoco puedan moverse.
Los polímeros son iguales. Cuando la temperatura es alta, las cadenas pueden moverse con facilidad. De modo que cuando usted toma una porción de polímero y la dobla, las moléculas, que ya están en movimiento, no tendrán problemas en moverse hacia nuevas posiciones, a fin de aliviar la tensión que usted está ejerciendo sobre ellas. Pero si usted trata de doblar una muestra de polímero por debajo de su Tg, las cadenas ya no podrán desplazarse hacia otras posiciones. Y justamente como en el ejemplo de la habitación repleta de víboras, sucederá una de dos cosas. O las cadenas (A) serán lo suficientemente resistentes como para soportar la fuerza que se está ejerciendo y la muestra no se doblará; o bien (B) la fuerza que se está aplicando es demasiado grande para que las inmóviles cadenas poliméricas puedan resistirla y ya que no pueden moverse a su alrededor para aliviar dicha tensión, la muestra se quebrará o se romperá en sus manos.
Este cambio de movilidad con la temperatura ocurre porque el fenómeno que llamamos "calor" es en realidad un tipo de energía cinética, o sea, la energía de los objetos en movimiento. En otras palabras, es un efecto del movimiento caótico de las moléculas. Las cosas están "calientes" cuando sus moléculas tienen una gran cantidad de energía cinética y se mueven con facilidad. Las cosas están "frías" cuando sus moléculas no tienen energía cinética y se mueven lentamente o no se mueven.
La temperatura exacta a la cual las cadenas poliméricas experimentan este gran cambio en su movilidad, depende de la estructura del polímero. Para ver cómo un pequeño cambio en la estructura puede significar un gran cambio en la Tg, observe la diferencia entre el poli(metil acrilato) y el poli(metil metacrilato) en la página de los acrilatos.
Hay una diferencia entre los polímeros y las serpientes, que deberíamos discutir en este punto. Una víbora no sólo se contornea, sino que en realidad se mueve de un lado hacia otro. Esto se denomina movimiento traslacional. Cuando usted camina por la calle, asumiendo que no sea como tantos que nunca van hacia ningún lado, está realizando un movimiento traslacional. Si bien los polímeros no se encuentran impedidos de efectuar dicho movimiento, por lo general no lo hacen. Pero sí se contornean de diversas formas, como los niños pequeños en una iglesia, o un fumador que se abstiene de fumar durante mucho tiempo. En el momento en que trasponemos la temperatura de transición vítrea y seguimos bajando, el entorno ya se vuelve demasiado frío como para que las moléculas del polímero, enredadas entre sí como están, se muevan en alguna dirección. El movimiento que permite que un polímero sea flexible, no es generalmente el traslacional, sino uno conocido como movimiento segmental de rango largo. Si bien la totalidad de la cadena polimérica puede parecer no desplazarse hacia ninguna dirección, los segmentos de dicha cadena pueden en cambio, serpentear, balancearse y rotar como un tirabuzón gigante. Así, los polímeros pueden imaginarse como una multitud en una pista de baile. Aunque cada individuo parece estar en el mismo lugar, muchos brazos, piernas y cualquier cosa, están cambiando continuamente de posición. Cuando la temperatura cae por debajo de la Tg, la fiesta se acabó para los polímeros y el movimiento segmental de rango largo se termina. Cuando este movimiento se detiene, ocurre la transición vítrea y el polímero cambia de un estado blando y flexible a otro rígido y quebradizo.
¿Quiere divertirse? En primer lugar, haga que su profesor lleve un poco de nitrógeno líquido a la clase. Luego, vierta una porción sobre un vaso de espuma de estireno y arroje algunos objetos caseros hechos con polímeros, como banditas de goma o bolsas plásticas. El nitrógeno líquido, siendo tan gélido como es, enfriará los objetos por debajo de sus temperaturas de transición vítrea. Ahora trate de flexionar su bandita de goma (sosténgala con una pinza, ya que podría congelarse si intenta tocarla con sus dedos) ¡y se quebrará en pedazos! Genial, ¿no? La bandita de goma se quebrará porque se encuentra por debajo de su temperatura de transición vítrea.
¿Desea saber más sobre la maravillosa transición vítrea? ¡Lea estos segmentos!
A veces, un polímero tiene una Tg más alta de lo deseado. No importa, sólo le agregamos algo llamado un plastificante. Se trata de una pequeña molécula que penetrará entre las cadenas poliméricas y las separará. Esto se conoce como aumentar el volumen libre. Cuando esto ocurre, las cadenas pueden deslizarse entre sí con mayor facilidad. Y al deslizarse con mayor facilidad, podrán moverse a temperaturas más bajas de lo que lo harían sin el plastificante. De esta forma, la Tg de un polímero puede ser disminuida, con el objeto de hacerlo más flexible y más fácil de manipular.
Si usted se está preguntando de qué clase de pequeña molécula estamos hablando, aquí hay algunas que se emplean como plastificantes:
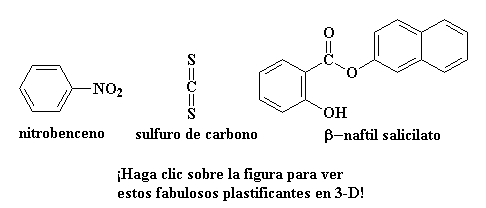
awww.
Palabras Claves:
Es común imaginar a la transición vítrea como a un tipo de fusión del polímero. Pero no es la manera correcta. Hay muchas diferencias importantes entre la transición vítrea y la fusión. Como dijimos antes, la fusión es algo que le ocurre a los polímeros cristalinos, mientras que la transición vítrea ocurre sólo en los polímeros en el estado amorfo. Un dado polímero a menudo tendrá dominios tanto cristalinos como amorfos, de modo que la muestra exhibirá un punto de fusión y una Tg. Pero las cadenas que funden no son las mismas cadenas que experimentan transición vítrea.
Existe otra gran diferencia entre fusión y transición vítrea. Cuando usted calienta un polímero cristalino a velocidad constante, la temperatura aumentará a velocidad constante. La cantidad de calor requerida para incrementar un grado Celsius la temperatura de un gramo de polímero, se denomina capacidad calorífica.
Sin embargo, la temperatura seguirá aumentando hasta que el polímero llegue a su punto de fusión. Cuando esto sucede, la temperatura se mantendrá constante por un momento, aún cuando se suministre más calor. Se mantendrá constante hasta que todo el polímero haya fundido completamente. Luego, la temperatura del polímero comenzará a ascender nuevamente. El aumento se detiene porque la fusión requiere energía. Toda la energía que usted agregue a un polímero cristalino en su punto de fusión, se utilizará en la fusión y no en un aumento ulterior de la temperatura. Este calor se denomina calor latente de fusión. (La palabra latente significa oculto.)
Una vez que el polímero fundió, la temperatura comienza a ascender de nuevo, pero ahora lo hace a una velocidad más lenta. El polímero fundido tiene mayor capacidad calorífica que el polímero cristalino en estado sólido, de modo que puede absorber más calor con incrementos de temperatura más pequeños.
Cuando un polímero cristalino funde, ocurren dos cosas: absorbe una cierta cantidad de calor, el calor latente de fusión, y experimenta un cambio en su capacidad calorífica. Cualquier cambio debido al calor, ya sea fusión o congelamiento, ebullición o condensación, que involucre un cambio en la capacidad calorífica y un calor latente, se denomina transición de primer orden.
Pero cuando usted calienta un polímero amorfo hasta su Tg, sucede algo diferente. Primero se calienta y la temperatura se eleva a una velocidad determinada por la capacidad calorífica del polímero, exactamente como vimos hasta ahora. Pero cuando se alcanza la Tg ocurre algo divertido. La temperatura sigue aumentando, no se detiene. No hay calor latente de transición vítrea. La temperatura se sigue incrementando.
Pero por encima de la Tg ya no lo hace a la misma velocidad que por debajo. El polímero experimenta un incremento en su capacidad calorífica luego de alcanzar la transición vítrea. Puesto que la transición vítrea involucra un cambio en la capacidad calorífica pero no un calor latente, esta transición se denomina transición de segundo orden.
Veamos los siguientes gráficos. Las curvas muestran la cantidad de calor suministrada al polímero en el eje y y la temperatura que debería obtenerse con una cantidad dada de calor en el eje x.
La curva de la izquierda muestra lo que ocurre cuando usted calienta un polímero 100% cristalino. Puede verse que la misma es discontinua. ¿Distingue la ruptura? Esa es la temperatura de fusión. En ese punto, se adiciona una gran cantidad de calor sin que provoque aumento alguno de la temperatura. Ese es el calor latente de fusión. Vemos que la pendiente se hace mayor una vez que se traspone la ruptura. Esta pendiente es equivalente a la capacidad calorífica, es decir que el aumento de la misma corresponde al aumento de capacidad calorífica por encima del punto de fusión.
Pero en el gráfico de la derecha, que muestra lo que ocurre con un polímero 100% amorfo cuando es calentado, no obtenemos una ruptura. El único cambio que vemos en la temperatura de transición vítrea, es un incremento de la pendiente, lo que significa, obviamente, que tenemos un aumento en la capacidad calorífica. Podemos observar un cambio en capacidad calorífica en la Tg, pero no una ruptura, como sí puede apreciarse en el caso de un polímero cristalino. Como dijimos antes, no hay calor latente involucrado en una transición vítrea.
Y ésto, mis amigos, justo delante de sus ojos, no es más que la diferencia entre una transición de primer orden, como la fusión, y una de segundo orden, como la transición vítrea.
Hasta ahora sabemos que algunos polímeros tienen Tg altas, y otros Tg bajas. Lo que todavía no nos preguntamos es: ¿por qué?. ¿Qué es lo que influye para que la transición vítrea de un polímero sean 100
oC y de otro 500 oC?
La respuesta es muy simple: todo depende de la facilidad con la que se muevan las cadenas. Una cadena polimérica que pueda movilizarse fácilmente, tendrá una Tg muy baja, mientras que uno que no se mueve tanto, tendrá una Tg alta. Cuanto más fácilmente pueda moverse un polímero, menor calor habrá que suministrarle para que las cadenas empiecen a contornearse para salir de un estado vítreo rígido y pasar a otro blando y flexible.
Y ahora supongo que ésto nos llevará a formularnos otra pregunta...
Este es el factor más importante para tener en cuenta. Cuanto más flexible sea la cadena principal, mayor será el movimiento del polímero y más baja será su Tg. Veamos algunos ejemplos. El más notable es el de las siliconas. Prestemos atención a una llamada polidimetilsiloxano.
¡Esta cadena principal es tan flexible, que el polidimetilsiloxano tiene una
Tg de -127 oC! Por ello es un líquido a temperatura ambiente y hasta se usa para espesar shampoos y acondicionadores de cabello.
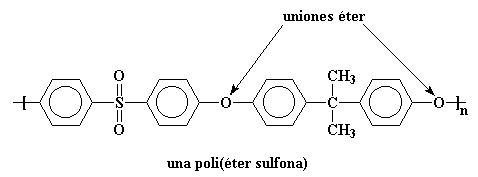
Ahora pasemos al otro extremo, la poli(fenilen sulfona).
La cadena principal de este polímero es extremadamente rígida. ¡Tanto, que el polímero no tiene Tg! Usted puede calentarlo a más de 500 oC y aún permanecerá en su estado vítreo. Es más, puede llegar a descomponerse ante tanto calor, pero no experimentará transición vítrea. Para hacer que el polímero sea procesable, debemos agregar algunos grupos flexibles a la cadena principal. Los grupos éter funcionan perfectamente.
Los polímeros como éste, se denominan poli(éter sulfonas), y esos grupos éter flexibles hacen que la Tg descienda a la temperatura mucho más adecuada de 190 oC.
Los grupos pendientes ejercen un gran efecto en la movilidad de la cadena. Incluso un grupo pequeño puede actuar como un anzuelo que atrapa cualquier molécula cercana cuando la cadena polimérica intenta moverse como un tirabuzón. Los grupos pendientes también pueden atraparse entre sí cuando las cadenas tratan de deslizarse una sobre otra.
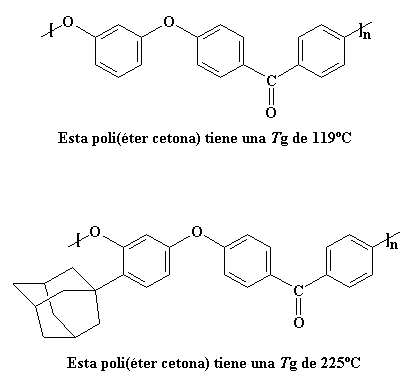
Uno de los mejores grupos pendientes para elevar la Tg es el voluminoso grupo adamantilo, derivado de un compuesto llamado adamantano.
Un grupo tan voluminoso como éste, hace algo más que comportarse como un anzuelo que atrapa moléculas vecinas e impide que el polímero se mueva. Es nada menos que un ancla de barco. No sólo atrapará moléculas cercanas, sino que además, su considerable masa es como una gran carga para el movimiento de su cadena polimérica, lo que hace que ésta se mueva mucho más lentamente. Para ver cuánto afecta ésto la Tg, vea dos poli(éter cetonas), una con un grupo adamantano pendiente y otra no.
La Tg del polímero de arriba es aceptable con sus 119
oC, pero el grupo adamantilo la eleva más aún, a 225 oC.
Pero los grupos voluminosos también pueden disminuir la Tg. Debido a su presencia, existe un límite para el empaquetamiento de las cadenas poliméricas. Cuanto más alejadas se encuentren unas de otras, se podrán mover con mayor facilidad. Esto disminuye la Tg, del mismo modo que un plastificante. La manera elegante de decir que existe más espacio disponible entre las cadenas poliméricas, significa decir que hay más volumen libre en el polímero. Por lo general, cuando más volumen libre exista, menor será la Tg. Podemos verlo mejor con una serie de polímeros metacrilato:
Puede observarse una gran disminución cada vez que alargamos esa cadena alquílica pendiente en un carbono. Empezamos con 120 o para el poli(metil metacrilato), pero cuando llegamos al
poli(butil metacrilato) la Tg ha bajado a apenas 20
oC, casi a temperatura ambiente.
Transición Vítrea vs. Fusión
transición de primer orden,
capacidad calorífica,
transición de segundo orden

¿Cuál es el Polímero de Mayor Tg?
Me alegro de que lo haya preguntado. Existen varios factores que afectan la movilidad de una cadena polimérica. ¡Veamos cada uno de ellos!
Flexibilidad de la Cadena Principal
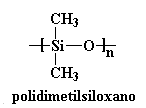

Grupos Pendientes Parte I:
Anclas y Anzuelos
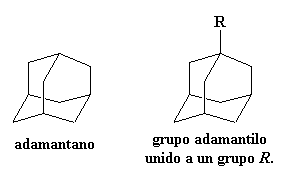
¡Haga clic sobre el adamantano para verlo en 3-D!
Grupos Pendientes Parte II:
Espacio Suficiente
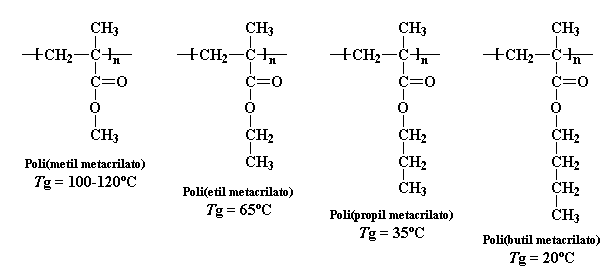
 Volver al Directorio del Nivel Tres
Volver al Directorio del Nivel Tres
 Volver al Directorio de Macrogalleria
Volver al Directorio de Macrogalleria