Preparazione del Diepossido
Questa fase è una polimerizzazione a stadi. Prepariamo il pre-polimero usando il bis-fenolo A e la eplcloridrina. Potete vedere queste molecole in 3-D cliccando qui. Questa è la reazione che potete vedere sulla pagina degli epossidi:
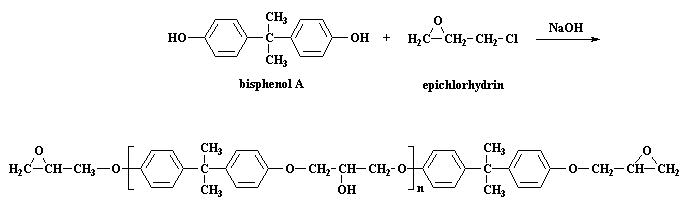
Come avviene questa reazione? Dapprima NaOH fa un piccolo scambio con il bisfenolo A, per dare il sale di sodio del bisfenolo A:
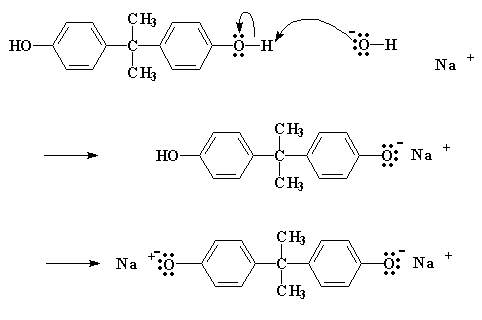
Cliccate qui per vedere questa fase della reazione
Il sale come potete notare, ha un atomo di ossigeno con tre coppie di elettroni che non condivide con nessuno. Questo particolare atomo di ossigeno è generoso e vuole spartire i suoi elettroni con gli atomi meno fortunati. Trova quindi un atomo di carbonio, su una epicloridrina vicina, che può utilizzare alcuni elettroni. Questo atomo è l'atomo di carbonio proprio vicino al cloro. Si suppone che il cloro abbia in comune una coppia di elettroni con quell'atomo di carbonio, ma essendo elettronegativo, tende ad accaparrarsi quella coppia.
L'ossigeno, essendo un atomo gentile, regala un paio dei suoi elettroni all'atomo di carbonio. Il carbonio, naturalmente, può spartire solo quattro coppie di elettroni alla volta, quindi una coppia se ne deve andare se vuole prendere la coppia dell'ossigeno. Lascia quindi andare gli elettroni che ha condiviso con il cloro e manda l'atomo di cloro per la sua strada, espellendolo dalla molecola.
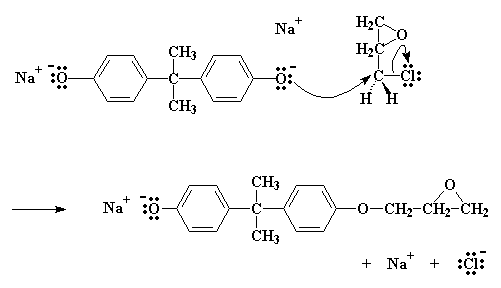
Cliccate qui per vedere questa reazione
Si termina con una molecola simile al bisfenolo A, con un gruppo epossidico in più. E si ottiene anche NaCl.
Cosa succede poi? Ci sono varie possibilità. Vi ricordate la pagina sull'epossido dove abbiamo parlato di come questi prepolimeri hanno diversi pesi molecolari? A volte il grado di polimerizzazione arriva fino a 25. A volte può essere piccolo come questo:
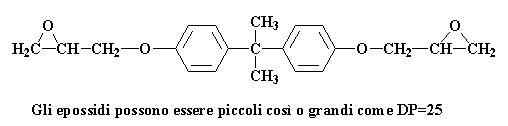
Il fatto che i prepolimeri siano grandi o piccoli dipende dal rapporto della epicloridrina con il bisfenolo A nella miscela di reazione. Mettiamo che il rapporto sia due molecole di epicloridrina per ogni molecola di bisfenolo A. Vediamo cosa succede alla molecola che abbiamo appena ottenuto con questo rapporto:
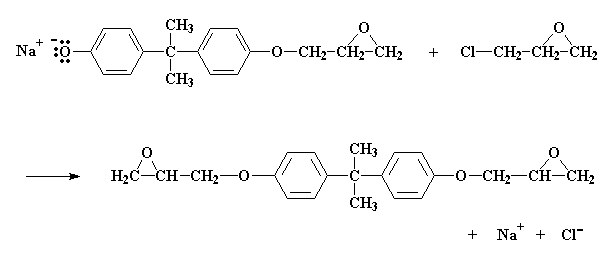
Otteniamo un gruppo epossidico anche sull'altro lato. La reazione a questo punto si ferma, in quanto non ci sono più gruppi salini di bisfenolo A in grado di reagire
Cosa succede se ci sono meno di due molecole di epicloridrina per ogni molecola di bisfenolo A? A questo punto non tutti i gruppi salini del bisfenolo A possono reagire con l'epicloridrina. Adesso il rapporto è di tre molecole di epicloridrina ogni due molecole di bisfenolo A. Quando tutte le molecole di epicloridrina hanno reagito rimane una miscela 50:50 delle due molecole:
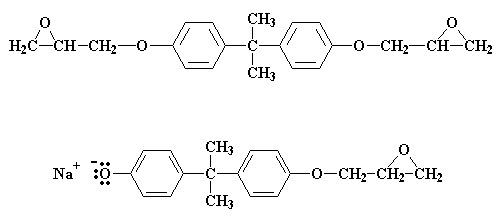
Queste due molecole reagiscono insieme per formare questa molecola:
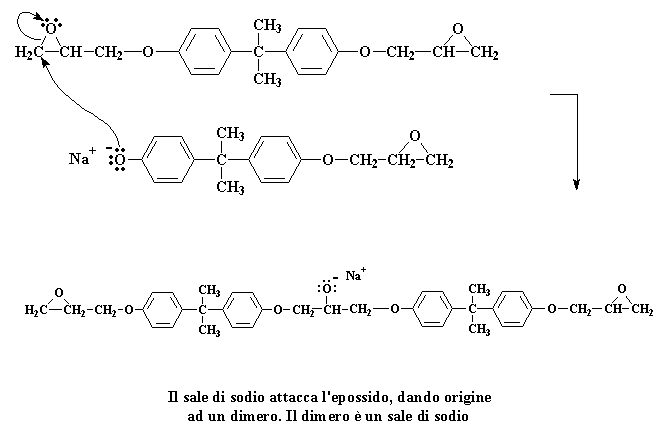
Cliccate qui per vedere questa fase della reazione
Abbiamo a questo punto un dimero che è un sale di sodio. Tenete bene presente la carica negativa sull'atomo di ossigeno. Quando si presenta una molecola d'acqua (ricordate, abbiamo preparato un gruppo di molecole d'acqua quando abbiamo preparato il sale di sodio del bisfenolo A) una coppia di elettroni dell'ossigeno attaccherà uno degli atomi di idrogeno dell'acqua, rubandolo dall'acqua.
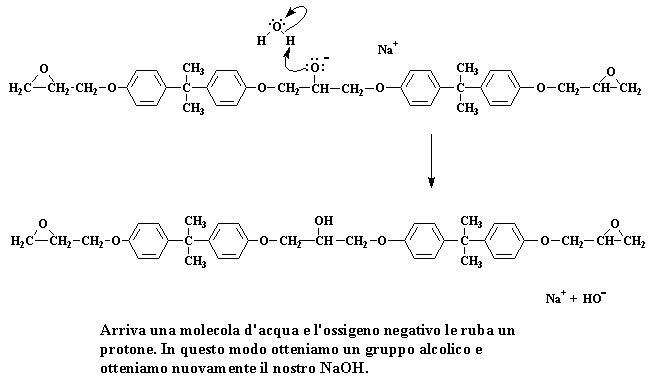
Cliccate qui per vedere questa fase della reazione
L'ossigeno forma un gruppo alcolico ed otteniamo nuovamente il nostro NaOH. Ricordate NaOH?
Più è elevata la quantità di epicloridrina rispetto alla quantità del sale di bisfenolo A più è grande l'oligomero che si ottiene. Riuscite a capire? Quale rapporto dovrete utilizzare per avere dei trimeri?
Una volta ottenuti i vostri
prepolimeri diepossidici, dovete legarli tutti insieme. Si può fare
questo aggiungendo una diammina. La diammina fa una cosa molto divertente
quando vede questi gruppi epossidici alle estremità dei prepolimeri.
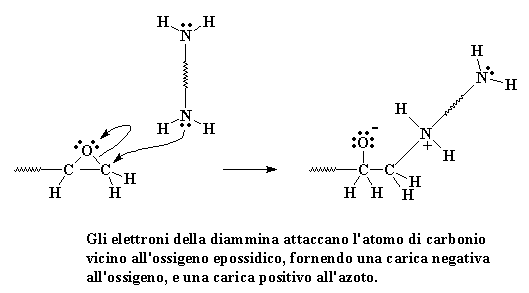
Le coppie di elettroni abbandonate sui gruppi amminici cercheranno quesi
gruppi epossidici, e vedranno che l'ossigeno epossidico, essendo elettronegativo,
risucchierà tutti gli elettroni dagli atomi di carbonio vicini.
Gli elettroni cercano questi atomi di carbonio e vedono che possono facilmente
dare i loro elettroni all'atomo di carbonio all'estremità della
molecola.
Cliccate qui per vedere questa fase della reazione
Quando si comportano così
il carbonio rinuncia agli elettroni che spartiva in modo irregolare con
l'ossigeno. Il legame tra il carbonio e l'ossigeno si rompe e si forma
un nuovo legame tra il carbonio e l'azoto amminico.
Rimane una carica negativa sull'ossigeno ed una carica positiva
sull'azoto.
Avete capito tutti ?
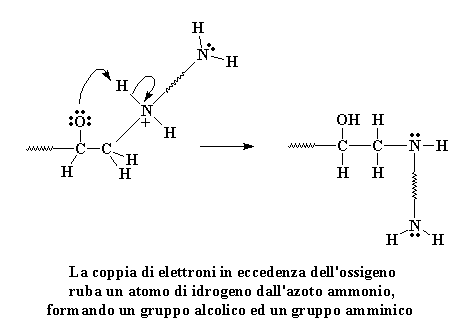
Date un'occhiata all'ossigeno.
All'ossigeno piacciono gli elettroni ma ha tre coppie di elettroni che
non condivide con nessun altro atomo. Anche l'ossigeno sa che non si può
avere troppo. Uno di questi elettroni senza legame si guarda intorno per
trovare qualche cosa con cui legarsi, e trova l'idrogeno attaccato dall'azoto
positivo. Questi elettroni poi attaccano l'idrogeno.
Cliccate qui per vedere questa fase della reazione
Quando attaccano formano un
legame con l'idrogeno e l'idrogeno si separa dall'azoto, lasciandosi dietro
i suoi elettroni. Si prende cura di quella carica positiva, lasciando l'azoto
neutro. Naturalmente anche l'ossigeno è neutro, avendo ottenuto
un protone, ed ora forma un gruppo alcolico.
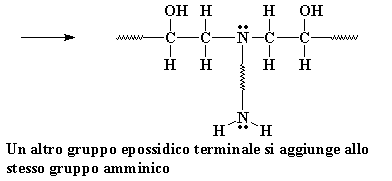
Il gruppo amminico ha ancora
un atomo di idrogeno e può reagire con un altro gruppo epossidico,
nello stesso identico modo. Può reagire con tanti gruppi epossidici
quanti sono gli atomi di idrogeno sull'ammina. Perché questo è
il risultato:
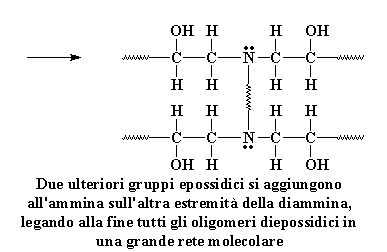
Ricordate stiamo usando una diammina, quindi il gruppo amminico sull'altra parte terminale della diammina può reagire anche con due gruppi epossidici. Alla fine si ottengono
quattro prepolimeri epossidici legati ad una molecola di diammina.
Ricordate, le altre estremità
dei prepolimeri diepossidici sono attaccati alle altre molecole di diammina.
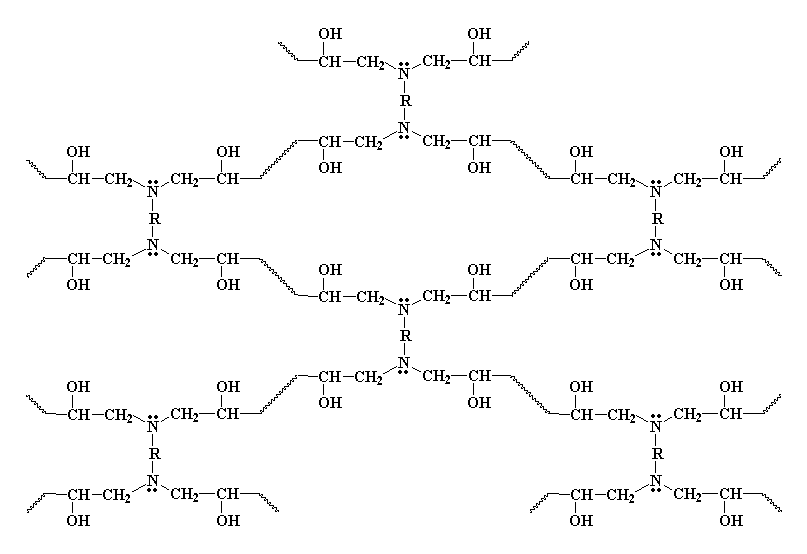
In questo modo tutte le molecole di diammina e tutte le molecole di diepossido
si legano una all'altra per formare una unica grande molecola, un reticolo
tridimensionale. Questa reticolo assomiglia un po� a questo:
Reticolazione del diepossido con la diammina
 Ritorna
alla Pagina sugli Epossidi
Ritorna
alla Pagina sugli Epossidi
 Ritorna
all'Indice del Quarto Piano
Ritorna
all'Indice del Quarto Piano
 Ritorna
all'Indice della Macrogalleria
Ritorna
all'Indice della Macrogalleria