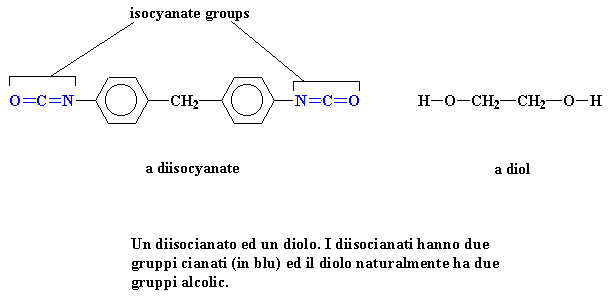
Un
diisocianato ed un diolo. I diisocianati hanno due gruppi cianati (in blu)
ed il diolo naturalmente ha due gruppi alcolici.
Potete vederli in 3-D cliccando qui, se volete.
E' la pagina più eccitante, certo! E' la pagina dove voi navigatori imparerete a produrre il poliuretano! No, non è così difficile. E' abbastanza semplice effettivamente. Ve lo dimostrerò…
Per iniziare, si ottiene il poliuretano da due monomeri, un diolo ed un diisocianato. Possiamo dare un'occhiata? Eccoli qui proprio qui sotto:

Un
diisocianato ed un diolo. I diisocianati hanno due gruppi cianati (in blu)
ed il diolo naturalmente ha due gruppi alcolici.
Potete vederli in 3-D cliccando qui, se volete.
Con l'aiuto di una piccola molecola chiamata diazobiciclo[2.2.2.]ottano, o DABCO abbreviato, possiamo polimerizzarli. Quando mescoliamo i due monomeri con il DABCO, accade qualche cosa di eccezionale.
DABCO
è veramente un buon nucelofilo, ossia, ha una coppia di elettroni
non condivisi che vorrebbero legarsi ad un nucleo vulnerabile. Ricordate
gli elettroni hanno cariche negative ed i nuclei degli atomi hanno cariche
positive. Tutti sappiamo che le cariche negative e le cariche positive
si attraggono. Gli elettroni del DABCO si guardano intorno e trovano un
nucleo sugli atomi di idrogeno alcolico del diolo. Questi atomi di idrogeno
sono vulnerabili, poiché sono legati agli atomi di ossigeno. L'ossigeno
è elettronegativo, ossia porta via gli elettroni dagli altri atomi.
Porta via gli elettroni dal suo vicino, l'atomo di idrogeno, sbilanciando
la carica positiva del suo nucleo. Gli elettroni avrebbero bilanciato la
carica positiva con le loro cariche negative, ma sono stati risucchiati
dall'ossigeno. Rimane quindi una carica positiva debole sull'atomo di idrogeno.
.
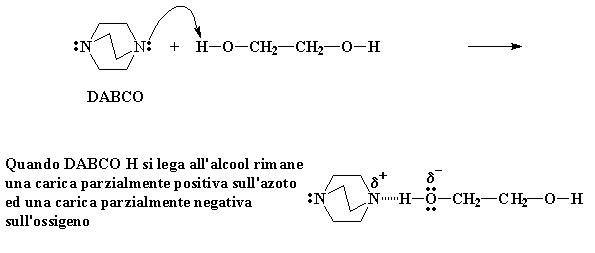
Cliccatequi
per vedere questa reazione.
Quando DABCO H si lega all'alcool rimane una carica parzialmente positiva sull'azoto ed una carica parzialmente negativa sull'ossigeno
Gli elettroni del DABCO vedono cosa è successo e non sanno cosa fare. Corrono avanti e formano un legame idrogeno tra l'idrogeno e l'azoto del DABCO. Questo legame-H lascia una carica parzialmente positiva sull'azoto, ma cosa più importante, una carica parzialmente negativa sull'ossigeno. Questa carica parzialmente negativa rende l'ossigeno molto caldo, essendo così caldo deve reagire con qualche cosa.
Volete sapere con che cosa reagirà?
L'ossigeno ha un'eccedenza
di elettroni, quindi reagirà con qualche cosa a cui mancano gli
elettroni. Se diamo un'occhiata al nostro isocianato possiamo vedere che
il carbonio nel gruppo isocianato rimane tra due elementi elettronegativi,
ossigeno ed azoto. Anche questo atomo di carbonio sarà molto povero
di elettroni. Il nostro ossigeno molto caldo non perde tempo a reagire
con esso. Lancia una coppia di elettroni a quell'atomo di carbonio e si
forma un legame.
Cliccate qui per vedere questa reazione
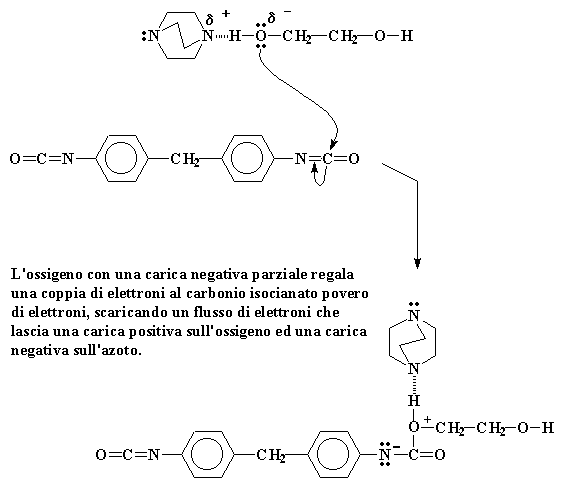
L'ossigeno con una carica negativa parziale regala una coppia di elettroni al carbonio isocianato povero di elettroni, scaricando un flusso di elettroni che lascia una carica positiva sull'ossigeno ed una carica negativa sull'azoto.
Naturalmente questo spinge una coppia di elettroni lontano dal doppio legame carbonio-azoto. Questa coppia si posiziona sull'azoto cedendogli una carica negativa. Il nostro ossigeno nel frattempo, avendo regalato una coppia di elettroni, rimane con una carica positiva.
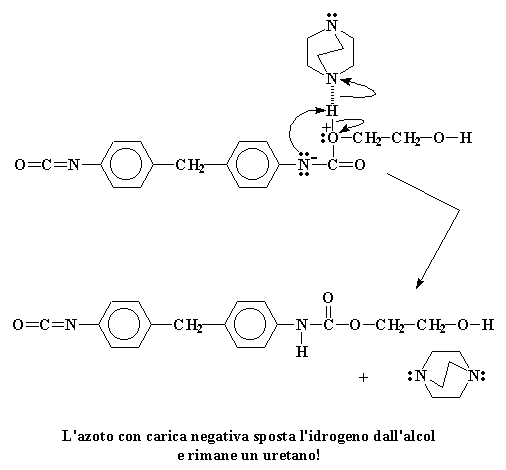
Non esiste cosa peggiore per l'atomo di azoto che avere una carica negativa, per questo motivo cerca di eliminarla appena può. Il modo più semplice per farlo è regalare questa coppia al nostro vecchio amico, l'atomo di idrogeno alcolico. Si forma un legame tra quell'idrogeno e l'azoto.
Cliccate qui per vedere la reazione.
L'azoto con carica negativa sposta l'idrogeno dall'alcol e rimane un uretano!
Gli elettroni che l'idrogeno aveva in comune con l'ossigeno ora appartengono solo all'ossigeno. Viene quindi eliminata quella carica positiva che aveva l'ossigeno. Quando è tutto finito rimane uno stupendo nuovo dimero di uretano.
Se volete vedere il processo completo della formazione dell'uretano cliccate qui!
Questo dimero di uretano
ha un gruppo alcolico su una estremità ed un gruppo isocianato sull'altra,
così può reagire sia con il diolo sia con il diisocianato
per formare un trimero. O può reagire con un altro dimero, o trimero,
o anche con oligomeri più grandi. In questo modo i monomeri e gli
oligomeri si combinano in continuazione fino a quando si ottiene un poliuretano
ad elevato peso molecolare.
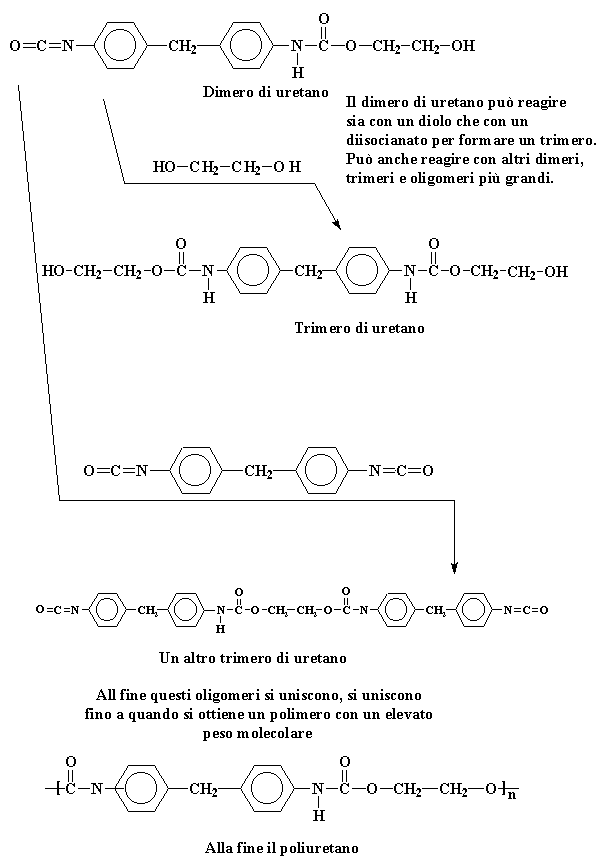
Il dimero di uretano può reagire sia con un diolo che con un diisocianato per formare un trimero. Può anche reagire con altri dimeri, trimeri e oligomeri più grandi.
Dimero di uretano - Trimero di uretano - Un altro trimero di uretano .
All fine questi oligomeri si uniscono, si uniscono fino a quando si ottiene un polimero con un elevato peso molecolare
Alla fine il poliuretano
Polimeri nei polimeri
A volte, invece di usare un piccolo diolo come il glicol etilenico, si utilizza un poliglicole , con un peso molecolare di circa 2000.
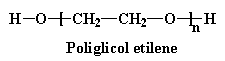
Noterete che non solo i monomeri reagiscono, ma anche i dimeri i trimeri e così via. Anche perché non vengono generate piccole molecole di sottoprodotto, è una polimerizzazione di addizione.
Si ottiene un polimero all'interno di un polimero, e si ottiene un poliuretano che assomiglia in qualche modo a questo:
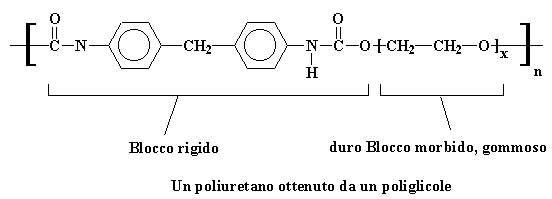
Blocco rigido, duro Blocco morbido, gommoso
Un poliuretano ottenuto da un poliglicole
Se volete potete sapere come si ottiene la schiuma di poliuretano.