

Dans la plupart des autres pages nous avons parlé de polymères dont la chaîne principale est faite essentiellement d'atomes de carbone. On appelle ces polymères des polymères organiques. Mais maintenant nous allons tourner le dos aux conventions et parler de quelques polymères qui n'ont pas d'atomes de carbone dans leur chaîne principale. On les appelle, si vous ne vous en doutez pas, des polymères inorganiques. Voici le menu pour vous aider à naviguer:
Vous avez déjà vu des polymères inorganiques; même si ce n'est pas dans ces pages, dans votre vie quotidienne vous avez certainement vu un polymère silicone quelque part. Les silicones sont les plus communs des polymères inorganiques. Il ressemble à ça:
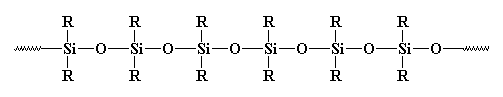
Il vaudrait mieux les appeler polysiloxanes. La liaison entre le silicium et l'oxygène est très forte, mais très flexible. Par conséquent les silicones peuvent supporter des températures élevées sans se décomposer mais ils ont une température de transition vitreuse très basse. Vous avez sûrement déjà vu du caoutchouc ou des joints en silicone.
Regardons l'élément silicium pendant un moment. Vous pouvez voir qu'il est juste en-dessous du carbone dans la classification périodique des éléments. Comme vous devez vous le rappeler, les éléments de la même colonne ou du même groupe de la classification périodique ont des propriétés très semblables. Donc si le carbone peut former de longues chaînes de polymères, le silicium devrait en être capable aussi.
Vrai?
Vrai. On a mis longtemps pour réussir à le faire, mais on a fait des chaînes de polymères avec les atomes de silicium. C'est dans les années 20 et 30 que les chimistes ont commencé à supposer que les polymères organiques étaient composés de longues chaînes de carbone, mais aucune recherche sérieuse sur les polysilanes ne fut entreprise avant la fin des années 70.
Plus tôt, en 1949, à peu près au moment où le romancier Kurt Vonnegut travaillait au département relations publiques de General Electric, C.A. Burkhard travaillait dans le département recherche et développement de la même entreprise. Il inventa un polysilane appelé polydiméthylesilane, mais ce matériau ne servait pas à grand-chose. Il ressemblait à ça:

Il formait des cristaux qui étaient si résistants que rien ne pouvait les dissoudre. Burkhard essaya de le chauffer, mais il ne fondit pas en-dessous de 250 oC, température à laquelle il se décomposa sans avoir fondu. Cela en fit un matériau assez inutile. Burkhard l'avait fabriqué en faisant réagir le sodium métallique avec le dichlorodiméthylesilane comme ceci:

C'est important car dans les années 70, quelques scientifiques eurent l'idée de faire de petits anneaux d'atomes de silicium. Et involontairement ils firent à peu près la même chose que Burkhard. Ils firent réagir le sodium métallique avec du dichlorodiméthylesilane, mais en plus ils ajoutèrent du dichlorométhylephénylesilane. Et devinez ce qui arriva? Je vais vous le dire: ils n'obtinrent pas les anneaux qu'ils voulaient. Ce qu'ils obtinrent fut un copolymère:

Le copolymère est peut-être mieux représenté comme ceci:

Les groupes phényles se mettent en travers lorsque le polymère essaye de cristalliser, il est donc moins cristallin que le polydiméthylesilane. Cela signifie qu'il est soluble, qu'il peut être mis en �uvre, que l'on peut l'étudier et jouer avec.
Alors à quoi il sert? Les Polysilanes sont intéressants car ce sont des conducteurs électriques. Pas aussi bons que le cuivre, mais bien meilleurs que ce que l'on attendrait d'un polymère, et très intéressants à étudier. Ils sont également résistants à la chaleur, presque 300 °C, et si vous les chauffez beaucoup plus, vous pouvez faire du carbure de silicium, qui est très utilisé comme abrasif.
Okay, alors si on peut faire des chaînes macromoléculaires avec le silicium, qu'en est-il des autres éléments du Groupe IV? Peut-on faire des polymères avec le germanium? Et bien croyez moi, on peut, et on peut même faire une macromolécule avec des atomes d'étain. Ces polymères sont appelés respectivement polygermanes et polystannanes.

Les polystannanes sont uniques, fabuleux , merveilleux ..., car ce sont les seuls polymères connus dont la chaîne principale est entièrement composée d'atomes métalliques. Comme les polysilanes, les polygermanes et les polystannanes sont étudiés dans le but d'être utilisés comme conducteurs électriques.
Je suis désolé que ça se finisse comme ça, mais nous n'avons plus d'éléments du Groupe IV. Donc le dernier polymère inorganique que nous allons voir aujourd'hui sera composé d'autre chose. Et cette autre chose, c'est le phosphore et l'azote. Comme dans les polysiloxanes, les chaînes de polyphosphazènes sont faites d'atomes alternés: alternativement azote et phosphore, comme ceci:

Cette chaîne est très flexible, comme la chaîne de polysiloxane, par conséquent les polyphosphazènes sont de bons élastomères. Ce sont aussi de très bons isolants électriques. Les polyphosphazènes sont fabriqués en deux étapes:

D'abord on prend du pentachlorure de phosphore et on le fait réagir avec du chlorure d'ammonium, pour obtenir un polymère chloré. Ensuite on le traite avec un alcool de sel de sodium et l'on obtient un polyphosphazène avec des liaisons éthers sur les groupes secondaires.
Copyright ©1996 | Department of Polymer Science | University of Southern Mississippi