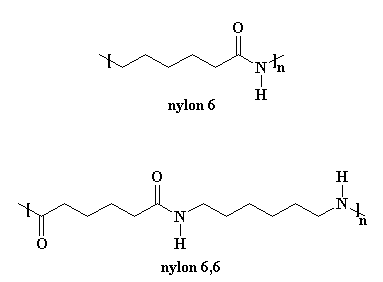

Il Nylon 6 è molto simile al nostro amico nylon 6,6. Potete vedere la figura se non ci credete.

Il procedimento necessario per ottenere il nylon 6 è molto diverso da quello per ottenere il nylon 6,6. Prima di tutto il nylon 6 è formato da un solo tipo di monomero, un monomero detto caprolattame. Il nylon 6,6 è formato da due monomeri,il cloruro di adipoile e la esametilendiammina (in scala di laboratorio; industrialmente si parte dall'acido adipico e dall'esametilendiammina).
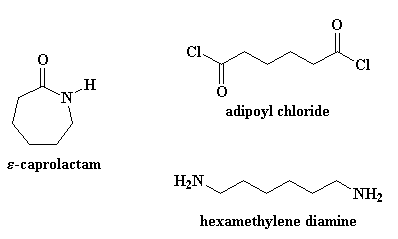
Se volete vedere il caprolattame in 3-D cliccate qui.
Non dilunghiamoci troppo. Procediamo con il metodo per trasformare il caprolattame in nylon 6. Il nylon 6 si ottiene scaldando il caprolattame a circa 250°C con il 5-10% di acqua. Cosa succede al caprolattame quando è circondato da acqua? L'ossigeno del carbonile si guarda intorno, e vede una molecola d'acqua, e capisce come sarebbe facile rubare uno degli atomi di idrogeno dell'acqua. Come spesso accade, una piccola cosa che sembra innocua può diventare molto più grande. Se date un'occhiata vedrete che l'avidità del caprolattame avrà la meglio.
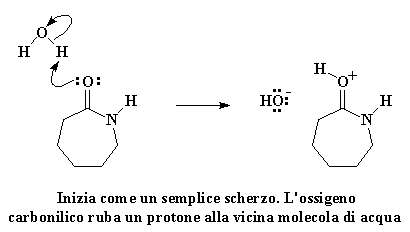
Cliccate qui per vedere questa reazione
L'ossigeno del carbonile regala una coppia di elettroni all'atomo di idrogeno dell'acqua, quindi ruba un atomo di idrogeno dall'acqua. Si ottiene quindi un carbonile con un protone ed un gruppo idrossile libero. Ricordatevi di questo gruppo idrossile, perché tornerà a cacciare l'avido caprolattame. Prima di tutto ricordiamoci che l'ossigeno del carbonile ha ora una carica positiva. Questo non gli piace, quindi ruba una coppia di elettroni dal doppio legame del carbonio, lasciando la carica positiva sull'atomo di carbonio del carbonile.
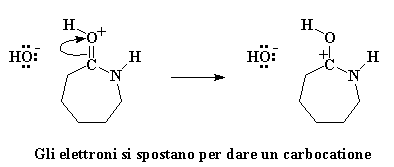
I carbocationi non sono creature felici. Mettere un carbocatione in una molecola è come chiedere ad un nucleofilo di venire ad attaccarlo. Nucleofilo? Qualcuno ha detto nucelofilo? Penso ce ne sia qualcuno da queste parti. E' quel vecchio ione idrossido che è rimasto quando il caprolattame ha rubato il protone dalla molecola d'acqua. Questo piccolo ione idrossido non è mai riuscito a superare effettivamente le emozioni negative dovute al fatto di aver perso il suo protone. Covando ancora molta ostilità attacca il carbocatione.
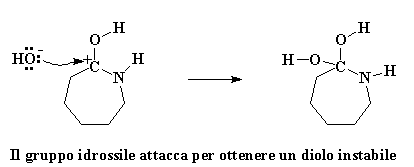
Clicca qui per vedere un flimato di questa reazione
La molecola che si è formata è ora un diolo geminale instabile. Instabile? Certo. Non vi ho detto che l'avidità del caprolattame lo avrebbe distrutto? Un rimescolamento impazzito di elettroni si avvicina. L'atomo di azoto regala una coppia di elettroni all'atomo di idrogeno su uno dei gruppi idrossili, rubandolo. Gli elettroni che l'idrogeno aveva in comune con il suo ossigeno si spostano per formare un doppio legame tra l'ossigeno e l'atomo di carbonio. Alla fine, gli elettroni condivisi dal carbonio e dall'azoto si spostano completamente verso l'azoto, spezzando il legame carbonio-azoto.
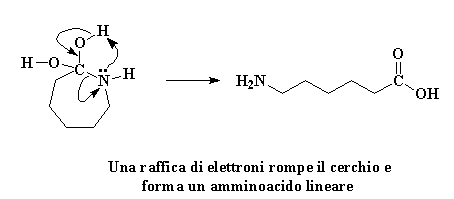
Cliccate qui per vedere questa reazione
Il cerchio è rotto, e il caprolattame non c'è più. Proprio come molti agenti di borsa che hanno trattato titoli spazzatura negli anni ottanta ha pagato cara la sua avidità. Ora rimane un amminoacido lineare.
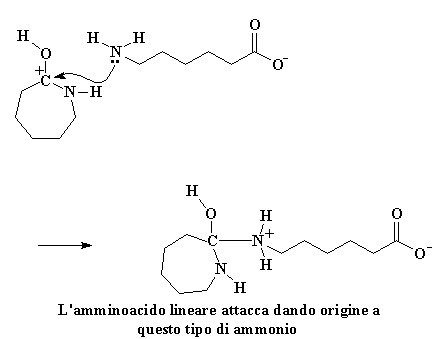
Ma la nostra storia non è ancora terminata. Vedete quell'amminoacido lineare può reagire con una molecola di caprolattame proprio come ha fatto la molecola d'acqua. Le molecole di caprolattame non sono molto furbe. Aver visto una di loro distrutta dalla sua avidità non le rende meno avide. Cercano comunque di rubare tutto ciò che possono dai loro fratelli caduti, come piccoli avidi polli. Sempre avida una molecola di caprolattame ruberà dal gruppo idrossilico l'idrogeno acido dall'amminoacido lineare. L'ossigeno del carbonile regala una coppia di elettroni a quell'idrogeno, rubandolo dall'amminoacido.
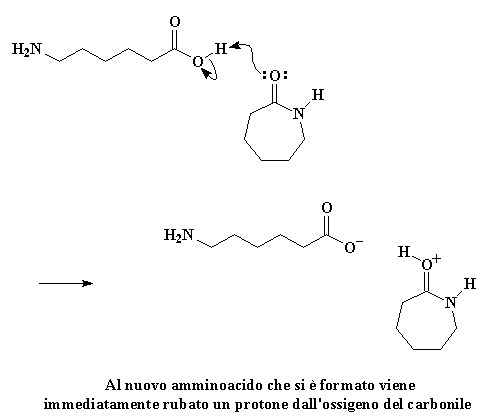
Cliccate qui per vedere questa reazione
Come previsto, gli elettroni si risistemano per formare un carbocatione, proprio come prima:
Questo carbocatione è ancora un invito aperto per qualsiasi nucleofilo lì vicino, ma questa volta, c'è un nuovo nucleofilo sul blocco. E' l'amminoacido che ha appena perso il suo idrogeno acido. Anch'esso è molto ostile verso il caprolattame, ed attacca proprio come abbiamo visto fare dallo ione idrossido in precedenza.
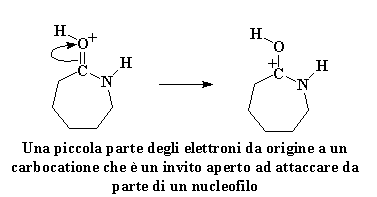
Ciò da origine ad un derivato amminico e questo, in particolare, è molto instabile. Gli elettroni fanno il gioco dei quattro cantoni. Per niente leale l'azoto nell'anello ruba un atomo di idrogeno dall'azoto del gruppo amminico . Inoltre il legame che unisce il carbonio e l'idrogeno viene spezzato. Un'altra avida molecola di caprolattame viene colpita.
Clicca qui per vedere questa reazione
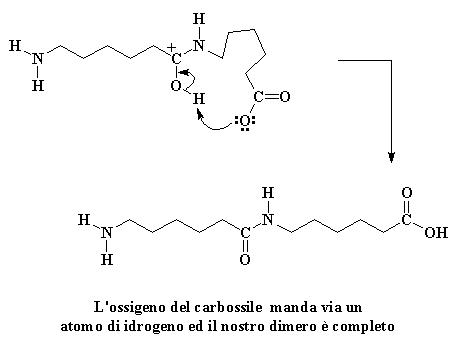
Non siamo ancora alla fine. Quel gruppo carbossilico alla fine della molecola sta per arrivare e rubare l'idrogeno del gruppo alcolico.
Clicca qui per vedere questa reazione
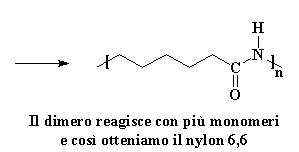
A questo punto un nuovo gruppo carbonile si trova al centro della molecola, e genera nuovamente l'acido carbossilico. (Vi dirò un piccolo segreto: nessuno conosce bene l'ordine delle ultime due fasi. Possono anche avvenire nell'ordine opposto. Sappiamo solo che entrambe avvengono prima che tutto sia finito. Se volete vedere un filmato di tutto il processo di propagazione cliccate qui. (Ricordate questa è la polimerizzazione a catena). Ora che abbiamo di nuovo un acido è certo che reagirà con un'altra avida molecola di caprolactam, poi un'altra e un'altra ancora fino a quando si ottiene una lunga catena di nylon 6.
 Ritorna
alla Pagina sul Nylon
Ritorna
alla Pagina sul Nylon
 Ritorna
all'Indice del Quarto Piano
Ritorna
all'Indice del Quarto Piano
 Ritorna
all'Indice della Macrogalleria
Ritorna
all'Indice della Macrogalleria