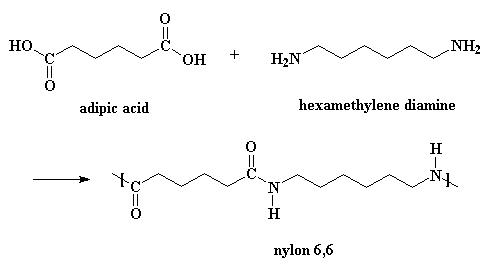
Questa pagina è interamente dedicata alla sintesi del nylon 6,6. Ve lo diciamo se per caso non siete in grado di leggere il titolo. Per iniziare il nylon si ottiene con una reazione denominata polimerizzazione a stadi e con una polimerizzazione per condensazione. I nylon si ottengono da diacidi e diammine. Se volete vedere come si presentano l'acido adipico e l'esametilendiammina in 3-D cliccate qui.

Naturalmente bisogna aggiungere qualche dettaglio alla reazione.
Per ottenere il nylon 6,6 non è necessario un catalizzatore, gli acidi catalizzano la reazione e, non ditemi che non lo sapevate, uno dei monomeri è un acido. Avviene una piccola reazione tra due molecole di acido adipico. Una regala un protone ad un ossigeno appartenete al carbonile di un altro.

Fase 1 Una molecola di acido adipico regala un protone all'ossigeno del carbonile dei un'altra molecola di acido adipico.
Cliccate qui per vedere questa reazione
Quando questo ossigeno riceve un protone, l'ossigeno del carbonile diventa molto più vulnerabile all'attacco dall'azoto della nostra diammina. Questo avviene perché il nostro ossigeno con protone porta una carica positiva. All'ossigeno non piace avere una carica positiva. Per questo attira verso di se gli elettroni che condivide con il carbonile. In questo modo il carbonio del carbonile rimane senza elettroni ed è pronto per riceverne una coppia dell'azoto amminico
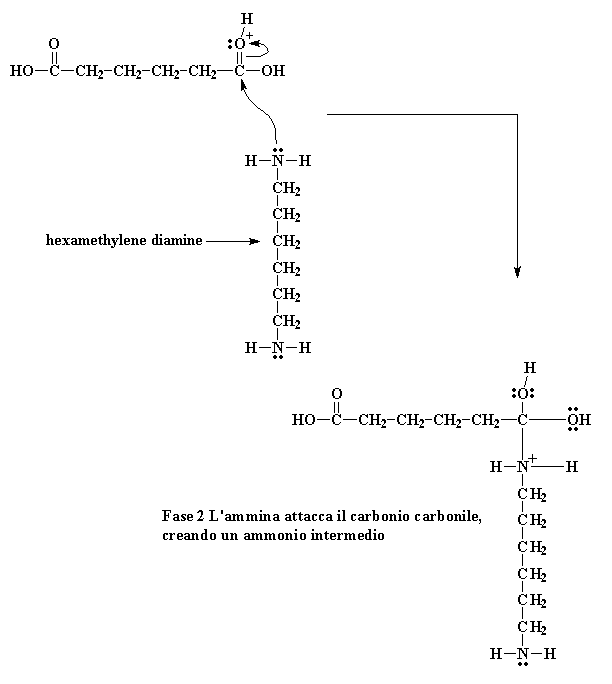
Fase 2 L'ammina attacca il carbonio carbonile, creando un ammonio intermedio
Cliccate qui per vedere questa reazione
Gli elettroni a questo punto fanno il gioco dei quattro cantoni. Un elettrone della coppia del doppio legame del carbonio si sposta completamente verso l'ossigeno, prendendo a cuore il problema della carica positiva su quell'atomo, ma ora il nostro azoto ha una carica positiva.
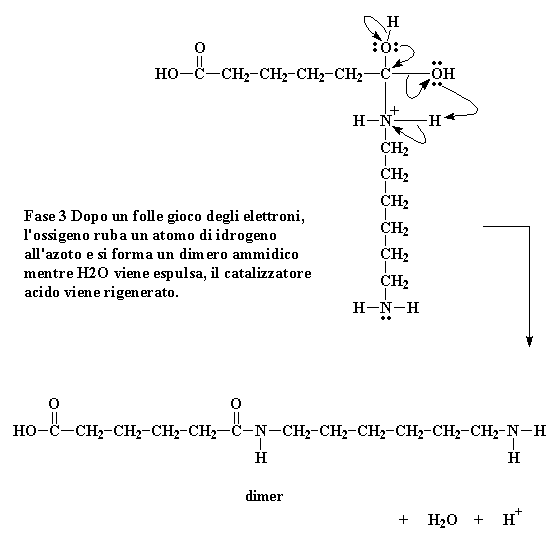
Fase 3 Dopo un folle gioco degli elettroni, l'ossigeno ruba un atomo di idrogeno all'azoto e si forma un dimero ammidico mentre H2O viene espulsa, il catalizzatore acido viene rigenerato.
Cliccate qui per vedere questa reazione
A questo punto assistiamo ad un gioco di elettroni ancora più elaborato. Gli elettroni del legame idrogeno ossigeno tornano dall'ossigeno, liberando il protone, rigenerando il catalizzatore acido. L'ossigeno carbonile a questo punto condivide i nuovi elettroni appena ricevuti con gli atomi di carbonio, rigenerando il doppio legame carbonilico.
Naturalmente questo non è sufficiente. L'ossigeno del gruppo idrossile decide di effettuare un po� di rimescolamento di elettroni per conto suo. Prende la coppia che ha in comune con il carbonio e se ne impossessa, spezzando il suo legame con il carbonio. Regala poi una coppia di elettroni all'idrogeno legato all'azoto.
L'atomo di idrogeno a questo punto medita. Poiché ora ha in comune una coppia di elettroni con l'ossigeno, non c'è motivo di tenere la coppia che condivide con l'azoto, la lascia andare, dandola all'azoto. Questo passaggio di elettroni rompe il legame tra l'idrogeno e l'ossigeno ed elimina la carica positiva di quell'atomo di azoto. Si separa dell'H2O e si genera il dimero contenente un'ammide.
Cosa fa ora questo dimero? Guardate bene e vedrete che ha un gruppo acido ad una estremità ed un gruppo amminico all'altra estremità. Significa che può reagire con una molecola di diacido o una molecola di diammina. In entrambi i casi si ottiene un trimero.
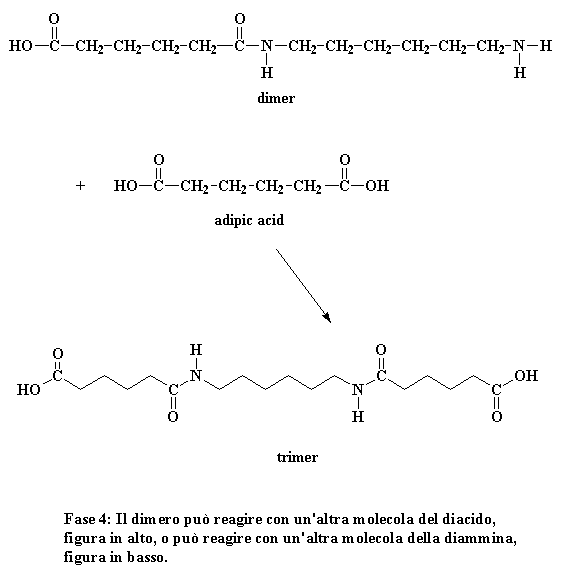
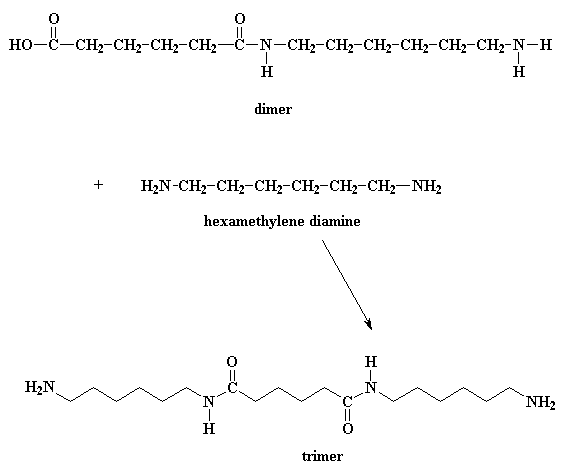
Fase 4: Il dimero può reagire con un'altra molecola del diacido, figura in alto, o può reagire con un'altra molecola della diammina, figura in basso.
Volete sapere un piccolo segreto? Il nostro dimero può reagire anche con altri dimeri, per formare un tetramero, se vuole. Può reagire con un trimero per formare un pentamero, e può anche reagire con oligomeri ancora più grandi. Alla fine quando questo si verifica i dimeri diventeranno trimeri, tetrameri e grandi oligomeri, e questi grandi oligomeri reagiranno uno con l'altro, per formare oligomeri ancora più grandi. Questo continua a verificarsi fino a quando diventano talmente grandi da essere chiamati polimeri.
�. alla fine
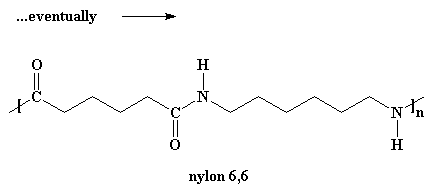
Per fare in modo che le molecole diventino abbastanza grandi da essere denominate polimeri, questa reazione deve essere effettuata sotto vuoto. In questo modo tutta l'acqua che si forma come sotto prodotto evapora e viene risucchiata. E' necessario eliminare l'acqua per una piccola regola chiamata il Principio di LeChatelier,
Vi ricordate quando all'inizio della lezione vi ho detto che questa reazione non ha bisogno di un catalizzatore acido per iniziare? Lo sappiamo perché verso la fine della polimerizzazione, quando non ci sono più molti gruppi acidi come catalizzatori, la reazione continua ad andare avanti. L'ammina può reagire con gli acidi carbossilici senza protoni. Se non fosse così non si potrebbe ottenere il nylon6,6, con il suo elevato peso molecolare, senza un catalizzatore esterno, in quanto la reazione si arresterebbe a conversioni più elevate, quando non rimangono più molti gruppi acidi come catalizzatori.
Volete sapere qualche cosa di più?
I nylon si possono ottenere anche da una diammina ed il cloruro di un diacido.
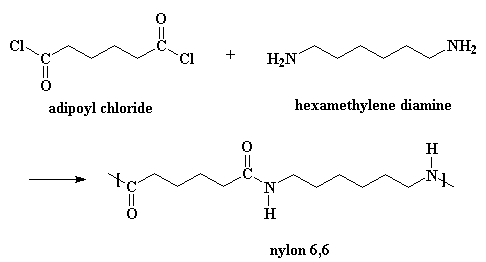
Questa reazione avviene con lo stesso meccanismo, ma è necessario aggiungere un po� di acido che agisca da catalizzatore. (Quando si prepara il nylon nell'altro modo, l'acido adipico agisce come catalizzatore) Produce inoltre gas HCl come sottoprodotto invece dell'acqua. Se volete vedere il filmato di questo metodo cliccate qui.
 Ritorna
alla Pagina sul Nylon
Ritorna
alla Pagina sul Nylon
 Ritorna
all'Indice del Quarto Piano
Ritorna
all'Indice del Quarto Piano
 Ritorna
all'Indice della Macrogalleria
Ritorna
all'Indice della Macrogalleria
Copyright ©1995,1996|Department of Polymer Science|University of Southern Mississippi